Iklan
Pertanyaan
Minyak bumi sebagian besar tersusun atas senyawa hidrokarbon, minyak bumi berasal sisa organisme hewan atau tumbuhan yang mati jutaan tahun yang lalu. Minyak bumi hasil pengeboran biasa disebut crude oil (minyak mentah). Dariproses pemisahan minyak bumi akan diperoleh berbagai bahan bakar. Bahan bakar yang saat ini paling banyak digunakan umat manusia adalah salah satunya adalah LPG (Liquiefied Natural Gas) dengan komponen utama propana( C 3 H 8 ) dan butana ( C 4 H 10 ) Hasil pembakaran sempurna propana dan butana menghasilkan gas karbondioksida danuap air menurut persamaan reaksi: C 3 H 8 ( g ) + 5 O 2 ( g ) → 3 CO 2 ( g ) + 4 H 2 O ( g ) 2 C 4 H 10 ( g ) + 13 O 2 ( g ) → 8 CO 2 ( g ) + 10 H 2 O ( g ) Berikut ini data entalpi pembakaran beberapa komponen minyak bumi: Maka enthalpi pembakaran untuk 2 C 4 H 10 ( g ) + 13 O 2 ( g ) → 8 CO 2 ( g ) + 10 H 2 O ( g ) adalah ...
Minyak bumi sebagian besar tersusun atas senyawa hidrokarbon, minyak bumi berasal sisa organisme hewan atau tumbuhan yang mati jutaan tahun yang lalu. Minyak bumi hasil pengeboran biasa disebut crude oil (minyak mentah). Dari proses pemisahan minyak bumi akan diperoleh berbagai bahan bakar. Bahan bakar yang saat ini paling banyak digunakan umat manusia adalah salah satunya adalah LPG (Liquiefied Natural Gas) dengan komponen utama propana() dan butana ()
Hasil pembakaran sempurna propana dan butana menghasilkan gas karbondioksida dan uap air menurut persamaan reaksi:
Berikut ini data entalpi pembakaran beberapa komponen minyak bumi:
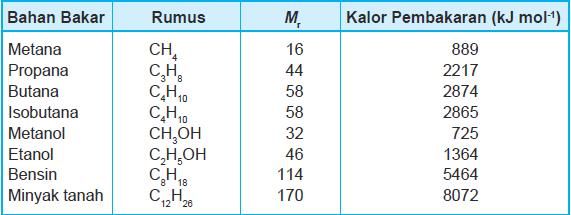
Maka enthalpi pembakaran untuk adalah ...
889
2217
2874
5464
5748
Iklan
I. Yassa
Master Teacher
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















