Iklan
Pertanyaan
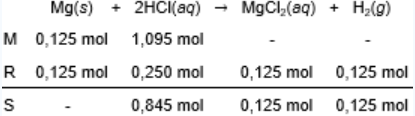
Logam magnesium dengan massa 3 gram direaksikan dengan larutan asam klorida yang mengandung HCl 40 gram. Reaksi yang terjadi adalah: Mg ( s ) + HCl ( a q ) → MgCl 2 ( a q ) + H 2 ( g ) Tentukan: pereaksi pembatas, gas hidrogen yang dihasilkan, diukur pada 27 ∘ C , 1 atm.
Logam magnesium dengan massa 3 gram direaksikan dengan larutan asam klorida yang mengandung 40 gram. Reaksi yang terjadi adalah:
Tentukan:
- pereaksi pembatas,
- gas hidrogen yang dihasilkan, diukur pada , 1 atm.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
12
4.5 (13 rating)
D
Dewayu
Pembahasan lengkap banget Makasih ❤️ Bantu banget Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia