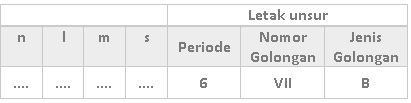
Tabel yang lengkap adalah sebagai berikut.
Posisi elektron di sekitar inti atom ditentukan dengan bilangan kuantum. Ada empat bilangan kuantum yang harus kamu ketahui yaitu, bilangan kuantum utama (n), bilangan kuantum azimut (l), bilangan kuantum magnetik (m), bilangan kuantum spin (s)
- Bilangan kuantum utama disimbolkan dengan huruf n. Bilangan ini akan menunjukkan ukuran orbital dan tingkat energi elektron, yang disebut kulit atom. Bilangan kuantum ini memiliki nilai 1, 2, 3, 4,… dan seterusnya
- Bilangan kuantum azimut memiliki simbol huruf l. Bilangan ini berguna untuk menunjukkan bentuk orbital dan sub tingkatan energi elektron (ditandai dengan s, p, d, f). Bilangan kuantum ini memiliki nilai dengan ketentuan s = 0, p = 1, d = 2, f = 3. Nilai ini akan menunjukkan di subkulit manakah elektron tersebut berada.
- Bilangan kuantum magnetik disimbolkan dengan huruf m. Bilangan ini menunjukkan posisi orbital terhadap orbital lain di dalam subkulit atom. Nilai bilangan kuantum magnetik adalah -l sampai +l.
- Bilangan kuantum spin menyatakan arah putar elektron. Hanya terdapat dua kemungkinan arah rotasi elektron, yakni searah atau berlawanan dengan arah jarum jam. Satu orbital hanya bisa ditempati oleh maksimum dua elektron, di mana kedua elektron tersebut harus memiliki spin yang berlawanan. Sehingga nilainya 21 untuk 1 elektron dan −21 untuk elektron kedua dalam satu orbital.
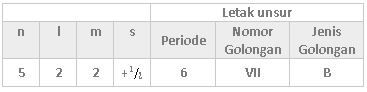
Suatu unsur yang terletak pada periode 6 artinya elektron terakhir dari atom tersebut terletak pada kulit n = 6. Nomor golongan menyatakan jumlah elektron valensi, sehingga elektron valensi unsur tersebut adalah 7. Unsur pada golongan B memiliki konfigurasi elektron yang berakhir pada kulit d, sehingga kita bisa menentukan konfigurasi elektron tersebut berakhir pada subkulit 6s2 5d5. Karena elektron terakhir berada pada subkulit 5d maka nilai n adalah 5 sedangkan nilai l = 2. Untuk menentukan nilai m dan s maka kita perlu menggambarkan diagram orbitalnya.
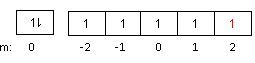
Dari diagram orbital tersebut elektron terakhir yang berwarna merah berada pada orbital d dengan nilai m = 2. Karena hanya ada 1 elektron pada orbital maka nilai s = +21.

Dengan demikian, nilai bilangan kuantum elektron terakhirnya yaitu n = 5, l = 2, m = +2, dan s = +21.