Tabel Lengkap:

Satu mol menyatakan jumlah zat suatu sistem yang mengandung sejumlah besaran elementer (atom, molekul, dan ion) yang setara dengan banyaknya atom yang terdapat dalam 12 gram tepat isotop Karbon-12 (C-12). Jumlah besaran elementer tersebut disebut sebagai tetapan Avogadro dan dilambangkan dengan R. Besarnya tetapan Avogadro ditentukan secara eksperimen, dan harga tetapan Avogadro sebesar 6,02×1023 partikel.
Hubungan mol dengan gas yaitu pada suhu dan tekanan tertentu akan selalu berlaku bahwa semakin besar volume suatu gas maka jumlah partikel dalam gas tersebut juga akan semakin banyak yang artinya jumlah mol gas akan semakin besar. Ada beberapa kondisi khusus mengenai hubungan antara volume gas dengan mol (n) yaitu:
- Kondisi Standar : dilakukan pada suhu 0°C dan tekanan 1 atm, yang kemudian dikenal sebagai Standart Temperature and Pressure (STP) yang diperoleh nilai Volume molarnya sebesar 22,4 Liter
- Suhu Ruang : dilakukan pada suhu 25°C dan tekanan 1 atm, yang kemudian dikenal sebagai Room Temperature and Pressure (RTP) yang diperoleh nilai Volume molarnya sebesar 24 Liter
- Keadaan pada Suhu dan Tekanan Tertentu: Merupakan kondisi yang terlepas dari 2 kondisi diatas, yang disebut dengan kondisi gas ideal
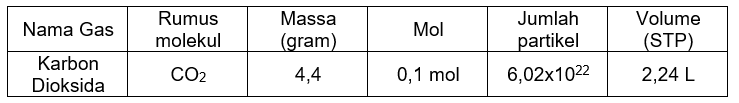
Rumus molekul Karbon dioksida adalah CO2. Dicari mol dari jumlah partikel dan bilangan avogadro:
Jumlah partikel = n×L6,02×1022 = n×6,02×1023n =0,1 mol
Dicari massa yang ada:
Mr CO2=(1×C)+(2×O)Mr CO2=(1×12)+(2×16)Mr CO2=44 gr/mol
n=Mrm0,1 mol=44 gr/molmm=4,4 gram
Dicari volume dari volume molar (STP):
V=n×VmV=0,1 mol×22,4 liter/molV=2,24 liter



















