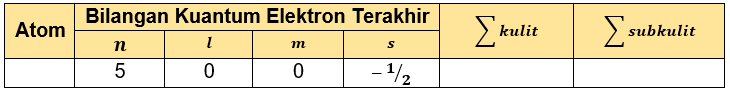
Tabel yang lengkap adalah sebagai berikut.
Konfigurasi elektron dan nama unsur dapat ditentukan dari keempat bilangan kuantum pada elektron terakhir. Keempat bilangan kuantum dapat disusun menjadi elektron terakhir dengan aturan:
- Bilangan kuantum utama (n), yang menunjukkan kulit atom.
- Bilangan kuantum azimuth (l), yang menunjukkan subkulit atom.
- Bilangan kuantum magnetik (m), yang menunjukkan orientasi orbital.
- Bilangan kuantum spin (s), yang menunjukkan arah rotasi elektron.
Berdasarkan keterangan tersebut, maka:
Elektron terakhirnya adalah:
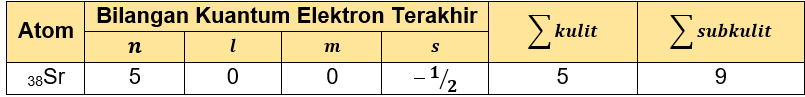
Dengan n = 5, l = 0, m = 0, dan s = −21, maka dapat diketahui elektron terakhirnya ada pada subkulit 5s dengan jumlah elektron:
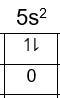
Konfigurasi elektronnya adalah: 1s22s22p63s23p64s23d104p65s2
Jumlah subkulitnya adalah 9: 5 subkulit s, 3 subkulit p, dan 1 subkulit d.
Jumlah elektron dan unsurnya adalah:
Jumlah elektron dihitung dari konfigurasi elektronnya adalah 38, pada unsur netral, jumlah elektron sama dengan nomor atom. Unsur dengan nomor atom 38 pada sistem periodik unsur adalah 38Sr.
Sehingga tabel tersebut dapat dilengkapi: