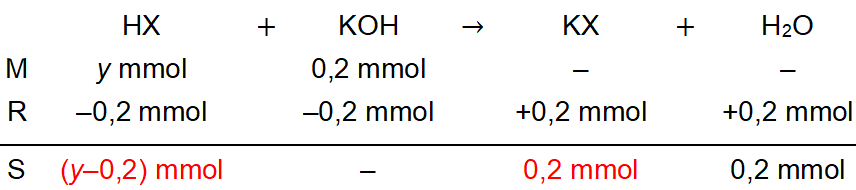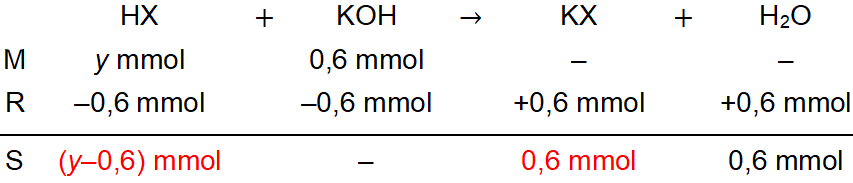Diketahui:
- V HX=70 mL
- M KOH=0,02 M
- pH1=4−log 4,5 → [H+]1=4,5×10−4
- pH2=5−log 3 → [H+]2=3×10−5
- V1=10 mL
- V2=30 mL
Ditanya: Nilai Ka
Jawaban:
Pada soal diketahui bahwa larutan yang terbentuk adalah larutan penyangga asam, artinya basa yang digunakan habis bereaksi. Dengan demikian, Ka dapat ditentukan dengan menggunakan persamaan berikut.
[H+]=Ka×n basa konjugasin asam
Langkah pengerjaan yang harus dilakukan adalah sebagai berikut.
Langkah 1: menentukan mol basa yang digunakan
Mol basa 1
n1=M×V1n1=0,02 M×10 mLn1=0,2 mmol
Mol basa 2
n1n1n1===M×V10,02 M×30 mL0,6 mmol
Langkah 2: menuliskan persamaan stoikiometris reaksi
Oleh karena pada soal tidak diketahui konsentrasi asam lemah yang digunakan, mol asam lemah mula-mula bisa dimisalkan menjadi y mmol.
Persamaan 1. Mol basa yang digunakan adalah mol basa 1 dengan pH 4 − log 4,5
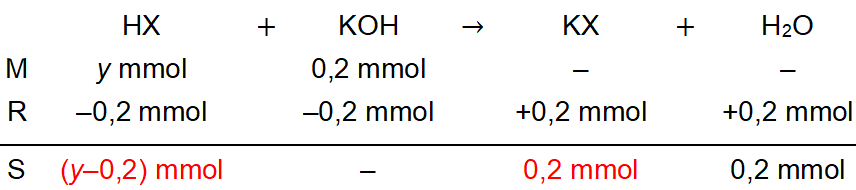
Penentuan mol basa konjugasi adalah sebagai berikut.
KX → K+ + X−0,2 mmol 0,2 mmol
Karena koefisien garam dan basa konjugasinya sama maka nilai molnya juga sama, yaitu 0,2 mmol.
[H+]4,5×10−49×10−5===Ka×n X−n HXKa×0,2(y−0,2)Ka(y−0,2) ..........(1)
Persamaan 2. Mol basa yang digunakan adalah mol basa 2 dengan pH 5 − log 3
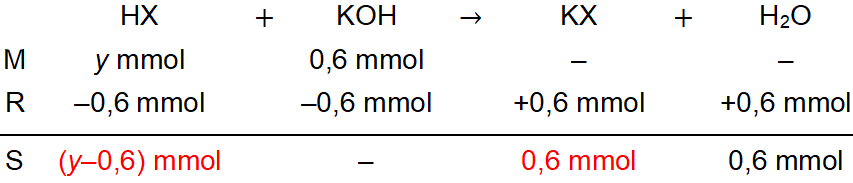
Penentuan mol basa konjugasi adalah sebagai berikut.
KX → K+ + X−0,6 mmol 0,6 mmol
Karena koefisien garam dan basa konjugasinya sama maka nilai molnya juga sama, yaitu 0,6 mmol.
[H+]3×10−51,8×10−5===Ka×n X−n HXKa×0,6(y−0,6)Ka(y−0,6) ..........(2)
Langkah 3: menentukan mol asam lemah mula-mula (nilai y)
Nilai y dapat ditentukan dengan membandingkan persamaan 1 dan 2.
1,8×10−59×10−555y−34yy=====Ka(y−0,6)Ka(y−0,2)(y−0,6)(y−0,2)y−0,22,80,7
Langkah 4: menentukan nilai Ka dengan substitusi pada salah satu persamaan
Substitusi y = 0,7 pada persamaan 1
9×10−59×10−5KaKa====Ka(y−0,2)Ka(0,7−0,2)0,59×10−51,8×10−4
Dengan demikian, konstanta disosiasi dari asam lemah (Ka) tersebut adalah 1,8×10−4.
Alasan opsi jawaban yang salah bisa dipilih adalah sebagai berikut.
- Jika menggunakan rata-rata [H+] sebagai nilai Ka, opsi B kemungkin dipilih.
- Jika dalam perhitungan, mol asam lemah yang digunakan adalah 0,02 M, volume basa dan [H+] yang digunakan adalah volume dan [H+] rata-rata, opsi C kemungkinan dipilih.
- Jika dalam perhitungan, mol asam lemah yang digunakan adalah 0,02 M, kemudian menghitung 2 nilai Ka dari nilai pH dan volume yang berbeda, dan pada akhirnya menghitung rata-rata nilai Ka yang diperoleh, opsi D kemungkinan dipilih.
- Jika [H+] yang digunakan saat perhitungan terbalik satu sama lain sehingga langkah pengerjaan 2 sampai 4 salah, opsi E kemungkinan dipilih.
Jadi, jawaban yang tepat adalah A.