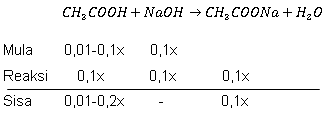Larutan penyangga adalah larutan yang menjaga pH dengan cukup konstan dan memiliki kemampuan untuk menahan perubahan pada pH saat pengenceran atau penambahan sedikit asam atau basa. Larutan penyangga dibagi ke dalam 2 jenis, yaitu larutan penyangga asam dan larutan penyangga basa.
Ada 2 cara pembuatan larutan penyangga, yaitu :
Cara langsung :
- campuran dari asam lemah dengan garam (basa konjugasi) yang disebut larutan penyangga asam. Contoh : CH3COOH + CH3COONa.
- campuran dari basa lemah dengan garam (asam konjugasi) yang disebut larutan penyangga basa. Contoh : NH4OH + NH4Cl.
Cara tidak langsung :
- Campuran asam lemah + basa kuat atau basa lemah + asam kuat, dengan mol asam/ basa lemahnya bersisa.
Larutan diatas merupakan larutan yang terbentuk dari basa kuat dan asam lemah, sehingga akan membentuk larutan penyangga asam. Langkah untuk menentukan volume larutan adalah sebagai berikut.
1. Menentukan mol asam dan basa yang bereaksi.
Volume total larutan adalah 100 ml = 0,1 L
Dimisalkan : volume NaOH=x
Volume CH3COOH=0,1−x
Maka nilai molnya adalah
mol NaOHmol CH3COOH======M×V0,1 M×x L0,1 molM×V0,1 M×(0,1−x) L0,01−0,1x mol
2. Mereaksikan asam dan basa sehingga ditemukan mol sisa.
Pada larutan penyangga asam, basa kuat akan habis bereaksi dan bersisa asam lemah.
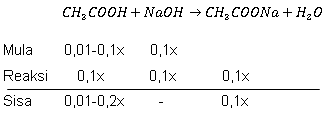
Mol asam lemah sisa reaksi adalah 0,01 - 0,2x dan mol garam (basa konjugasi) yang terbentuk adalah 0,1x.
3. Menentukan volume larutan asam dan basa.
Untuk menentukan volume maka dapat digunakan rumus pH larutan penyangga asam.
pH[H+]==610−6
[H+]10−610−610−10,01x0,21xx========Ka×mol garammol asam lemahKa×mol CH3COONamol CH3COOH10−5×0,1x0,01−0,2x0,1x0,01−0,2x0,01−0,2x0,010,0476 L47,6 mL
Volume NaOH = 47,6 mL
Volume CH3COOH = 100 mL - 47,6 mL = 52,4 mL
Jadi, volume NaOH dan CH3COOH yang dibutuhkan berturut-turut adalah 47,6 mL dan 52,4 mL.