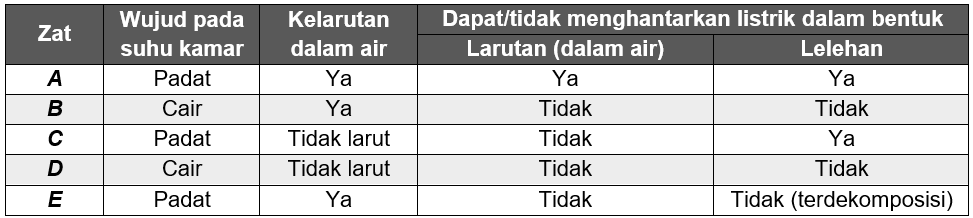
Senyawa yang dapat menghantarkan listrik adalah senyawa yang memiliki elektron atau ion-ion yang mampu bergerak bebas dan membawa muatan listrik. Hal yang perlu diperhatikan untuk menentukan senyawa memiliki ion-ion yang bergerak bebas adalah berdasarkan pada:
- Ikatan logam
Senyawa yang memiliki ikatan logam memiliki elektron yang bergerak bebas sehingga dapat menghantarkan listrik.
- Ikatan ion
Senyawa yang memiliki ikatan ion dapat menghantarkan listrik dalam bentuk lelehan dan larutan karena dalam bentuk tersebut, senyawa ion memiliki ion-ion yang bergerak bebas.
- Ikatan kovalen polar
Senyawa yang memiliki ikatan kovalen polar dapat menghantarkan listrik dalam bentuk larutan karena senyawanya mengalami reaksi ionisasi dalam air membentuk ion-ion yang bergerak bebas.
Berdasarkan penjelasan tersebut maka, zat A, B, C, D, dan E dapat diidentitfikasi sebagai:
zat A adalah NaCl karena merupakan garam yang larut dalam air dan memiliki ikatan ion sehingga mampu menghantarkan listrik dalam bentuk larutan maupun lelehan,
zat B adalah etanol karena berwujud cair dan larut dalam air. Etanol merupakan senyawa organik yang tidak dapat terionisasi sehingga tidak dapat menghantarkan arus listrik dalam bentuk larutan maupun lelehan.
zat C adalah timbel karena berwujud padat dan tidak larut dalam air. Timbel mampu menghantarkan listrik dalam bentuk lelehan.
zat D adalah karbon tetraklorida karena berwujud cair dan tidak larut dalam air. Karbon tetraklorida merupakan senyawa organik yang tidak dapat terionisasi sehingga tidak dapat menghantarkan arus listrik dalam bentuk larutan maupun lelehan.
zat E adalah karbon (berlian) karena berwujud padat dan larut dalam air namun tidak dapat terionisasi sehingga tidak dapat menghantarkan arus listrik dalam bentuk larutan maupun lelehan.
Jadi, zat A adalah NaCl, zat B adalah etanol, zat C adalah timbel, zat D adalah karbon tetraklorida, dan zat E adalah karbon (berlian).