Iklan
Pertanyaan
Kurva berikut diperoleh dari reaksi 1 gram pita magnesium dengan larutan HCI 1 M berlebih pada suhu 25°C. Salin kurva tersebut, kemudian tambahkan kurva sejenis untuk percobaan berikut: 1 gram pita magnesium dengan larutan HCI 1 M berlebih pada 50°C.
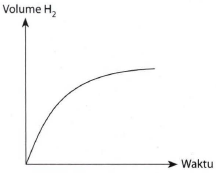
Kurva berikut diperoleh dari reaksi 1 gram pita magnesium dengan larutan HCI 1 M berlebih pada suhu 25°C.
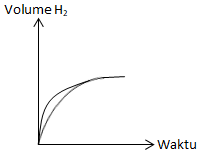
Salin kurva tersebut, kemudian tambahkan kurva sejenis untuk percobaan berikut: 1 gram pita magnesium dengan larutan HCI 1 M berlebih pada 50°C.
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
6
4.5 (2 rating)
am
alif maiya
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia