Iklan
Pertanyaan
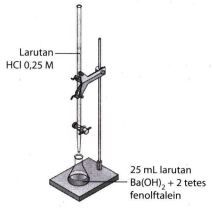
Kemolaran dari suatu larutan Ba ( OH ) 2 ditetapkan dengan percobaan seperti pada gambar berikut. Jika volume HCl yang digunakan sebanyak 25 mL, perhatikan beberapa pernyataan berikut. Titik akhir titrasi ditandai dengan perubahan warna dari tidak berwarna menjadi merah muda. Konsentrasi larutan = 0,25 M. pH titik ekivalen = 7. Pernyataan yang benar ditunjukkan oleh nomor ....
Kemolaran dari suatu larutan ditetapkan dengan percobaan seperti pada gambar berikut.
Jika volume HCl yang digunakan sebanyak 25 mL, perhatikan beberapa pernyataan berikut.
- Titik akhir titrasi ditandai dengan perubahan warna dari tidak berwarna menjadi merah muda.
- Konsentrasi larutan
= 0,25 M.
- pH titik ekivalen = 7.
Pernyataan yang benar ditunjukkan oleh nomor ....
1
2
3
1 dan 2
1 dan 3
Iklan
AM
A. Muhammad
Master Teacher
Mahasiswa/Alumni Universitas Pendidikan Indonesia
Jawaban terverifikasi
2
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia