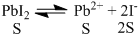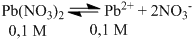Jawaban yang tepat adalah C.
Kelarutan (S) digunakan untuk menyatakan jumlah maksimum zat yang dapat larut dalam sejumlah tertentu zat pelarut atau larutan.
Dalam larutan jenuh PbI2 terdapat kesetimbangan antara PbI2 padat dengan ion Pb2+ dan ion I− dalam larutan sesuai persamaan reaksi berikut:
PbI2(s)⇌Pb2+(aq)+2I−(aq)
Hubungan kelarutan (S) dan tetapan hasil kelarutan untuk PbI2 adalah sebagai berikut:
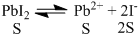
Ksp PbI2===[Pb+]×[I−]2S×(2S)24S3
Untuk mengetahui kelarutan perak PbI2 dalam larutan Pb(NO3)2 0,1 M, perlu dihitung dengan cara berikut:
1. Menghitung konsentrasi ion senama (Pb2+)
Ion senama (Pb2+) akan memperkecil kelarutan, tetapi tidak mempengaruhi harga tetapan hasil kali kelarutan asalkan suhu tidak berubah.
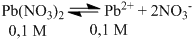
Ion Pb2+ = S + 0,1 M, namun karena jumlah ion Pb2+ dari PbI2 jauh lebih kecil daripada ion Pb2+ dari Pb(NO3)2, jumlah ion Pb2+ yang digunakan dalam perhitungan adalah jumlah ion Pb2+ yang berasal dari Pb(NO3)2 saja, yaitu 0,1 M.
2. Menghitung kelarutan Pbl2 dalam larutan Pb(NO3)2
Ksp PbI21,6×10−81,6×10−8S2S2S======[Pb2+]×[I−]20,1×(2S)20,1×4S20,1×41,6×10−84×10−82×10−4
Dari perhitungan di atas, dapat diketahui bahwa kelarutan Pbl2 dalam larutan Pb(NO3)2 0,1 M adalah 2×10−4.