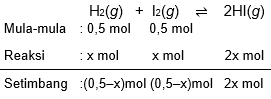Iklan
Pertanyaan
Ke dalam bejana yang volumenya 20 liter direaksikan 0,5 mol gas H 2 dan I 2 pada suhu T ∘ C , membentuk reaksi setimbang: H 2 ( g ) + I 2 ( g ) ⇌ 2 HI ( g ) Jika nilai tetapan kesetimbangan pada suhu tersebut adalah 36, tentukan konsentrasi masing-masing gas pada saat setimbang.
Ke dalam bejana yang volumenya 20 liter direaksikan 0,5 mol gas dan pada suhu , membentuk reaksi setimbang:
Jika nilai tetapan kesetimbangan pada suhu tersebut adalah 36, tentukan konsentrasi masing-masing gas pada saat setimbang.
Iklan
N. Puspita
Master Teacher
43
4.6 (14 rating)
M. Ariq Azzaky Ankanka
Pembahasan terpotong Ini yang aku cari!
Kinara Rajwaa Putri
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Latifa fadila isma
Makasih ❤️
Parikesit Galang
Ini yang aku cari! Pembahasan lengkap banget
Lastri Silaban
Mudah dimengerti
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia