Iklan
Pertanyaan
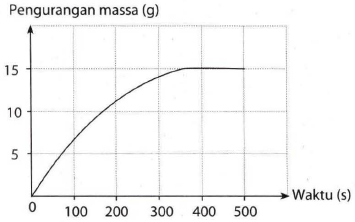
Kalsium karbonat (pualam) bereaksi dengan asam klorida menurut persamaan reaksi berikut: CaCO 3 ( s ) + 2 HCl ( a q ) → CaCl 2 ( a q ) + H 2 O ( l ) + CO 2 ( g ) Laju reaksi ini dapat ditentukan dengan mengukur pengurangan massa campuran. Salah satu hasil percobaan tersebut dapat dilihat pada grafik berikut: Berapakah massa CaCO 3 yang digunakan pada awal reaksi? (Ar C = 12, O= 16, dan Ca = 40).
Kalsium karbonat (pualam) bereaksi dengan asam klorida menurut persamaan reaksi berikut:
Laju reaksi ini dapat ditentukan dengan mengukur pengurangan massa campuran. Salah satu hasil percobaan tersebut dapat dilihat pada grafik berikut:
Berapakah massa yang digunakan pada awal reaksi? (Ar C = 12, O = 16, dan Ca = 40).
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
4
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia