Iklan
Pertanyaan
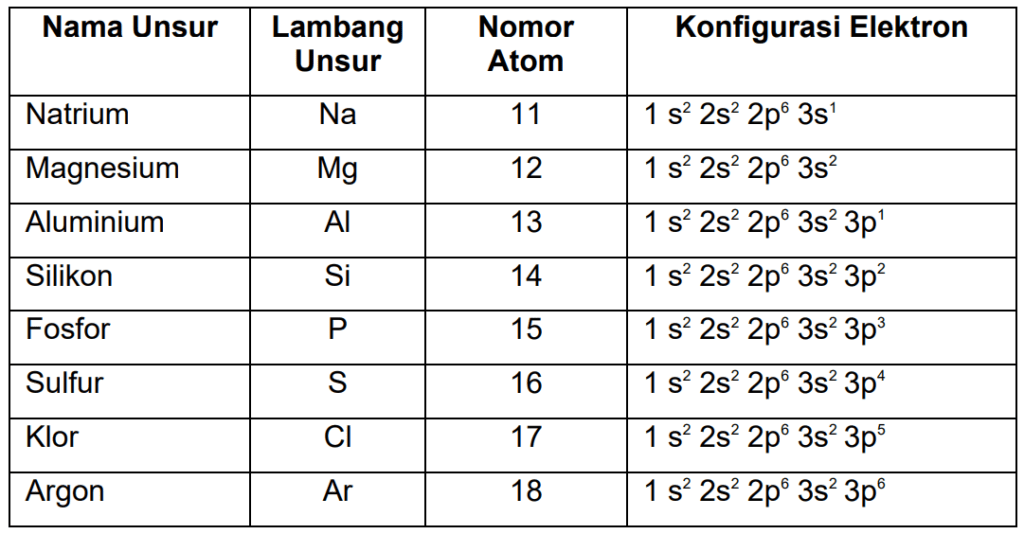
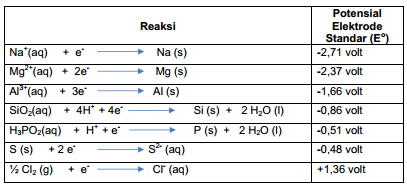
Jelaskan sifat reduktor dan oksidator unsur-unsur periode ketiga!
Jelaskan sifat reduktor dan oksidator unsur-unsur periode ketiga!
...
...
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
7
5.0 (5 rating)
AW
Alya Widya Ananta
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia