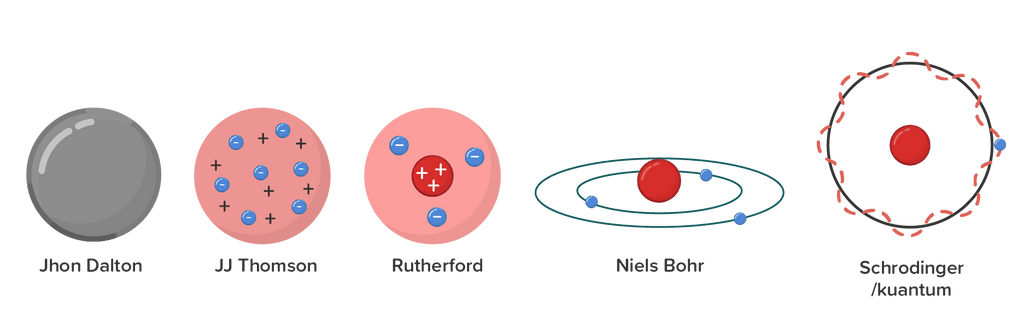
Perkembangan teori atom yang dikaji secara ilmiah dimulai oleh John Dalton, kemudian J. J. Thomson, Ernest Rutherford, dan teori atom modern atau mekanika kuantum.
Dalton menggambarkan atom sebagai bola pejal yang tidak dapat dibagi lagi, dimana atom dari unsur yang berbeda akan memiliki sifat yang berbeda.
Teori atom Thomson dimodelkan seperti roti kismis dimana atom terdiri atas materi yang bermuatan positif dan didalamnya tersebar elektron seperti kismis dalam roti kismis. Muatan positif dan muatan negatif yang bercampur menjadi satu dengan jumlah yang sama maka secara keseluruhan atom menurut Thomson bersifat netral.
Berdasarkan eksperimen epnembakkan sinar alfa pada pelat emas tipis, Rutherford mengusulkan bahwa atom tersusun dari dari inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif dan mengelilingi inti. Sebagian besar volume atom merupakan ruang kosong dan massa terpusat di inti atom.
Menjawab kelemahan teori atom Rutherford, Niels Bohr menyatakan elektron-elektron dalam atom hanya mampu melintasi lintasan-lintasan tertentu yang disebut dengan kulit atau tingkat energi. Teori atom ini diilustrasikan seperti susunan planet-planet dalam tata surya. Selama elektron dalam keadaan stasioner, elektron tidak memancarkan energi dan tidak menyerap energi. Elektron dapat berpindah dari tingkat energi rendah ke tingkat energi yang lebih tinggi dan sebaliknya.
Partikel kemudian ditemukan dapat memiliki sifat sebagai partikel dan dapat bersifat sebagai gelombang. Berdasarkan teori ini, posisi elektron tidak dapat dipastikan, namun dapat ditentukan kemungkinan keberadaan elektron yang disebut sebagai orbital.
Jadi, perkembangan teori atom dapat diringkas melalui gambar model atom sebagai berikut: