Berikut adalah konfigurasi Fe [Ar] 3d6 4s2 4p0.
Menentukan biloks Fe dalam ion kompleks:
biloks Fe+(6×muatan ligan CN)biloks Fe+(6×(−1))biloks Fe−6biloks Febiloks Fe=====−4−4−4−4+6+2
Fe dalam ion kompleks tersebut memiliki biloks +2.
26Fe2+ memiliki konfigurasi elektron [Ar] 3d6 4s0 4p0
26Fe2+: 
Berdasarkan konfigurasi tersebut, Fe2+ memiliki 4 elektron tak berpasangan.
Ligan CN- termasuk ke dalam ligan kuat dan menyebabkan terjadinya split energi. Split energi ini menyebabkan dari 5 orbital yang ada pada subkulit d, terbagi menjadi 2 tingkat energi, sehingga elektron tak berpasangan yang ada di subkulit d berpindah ke orbital yang energinya lebih rendah. Setelah terjadi spilitting, semua elektron yang ada pada subkulit d menjadi berpasangan.

Jenis ikatan yang terjadi antara atom pusat Fe dengan ligan CN adalah ikatan kovalen koordinasi. Ikatan Kovalen koordinasi adalah ikatan kovalen yang Pasangan Elektron Ikatannya hanya berasal dari salah satu atom yang berikatan. Pasangan elektron dari ligan masuk ke orbital Fe yang kosong, yaitu pada 2 orbital subkulit 3d, 1 orbital subkulit 4s dan 3 orbital subkulit 4p sehingga memiliki orbital hibridisasi d2sp3.
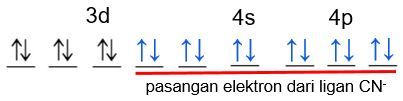
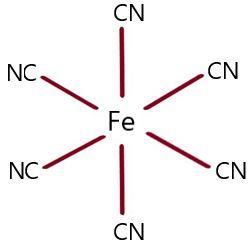
Dan memiliki geometri oktahedral.
Selain memiliki geometri oktahedral, pada soal juga diketahui bahwa ion kompleks tersebut bersifat diamagnetik. Diamagnetik adalah istilah untuk benda-benda yang tidak dapat ditarik oleh medan magnet. Sifat magnet pada ion kompleks ditentukan berdasarkan banyaknya elektron tak berpasangan yang terdapat pada subkulit d. Semakin banyak elektron tak berpasangan pada subkulit d, semakin kuat tertarik pada medan magnet.
Pada ion kompleks tersebut semua elektron berpasangan pada subkulit d. Hal tersebutlah yang menyebabkan ion kompleks [Fe(CN)6]4− bersifat diamagnetik.
Jadi, ion kompleks [Fe(CN)6]4- terbentuk dari ikatan kovalen koordinasi antara atom pusat Fe dengan 6 ligan CN dan membentuk geometri oktahedral.
geometrinya!
oktahedral



















