Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh elektron valensinya yang berjumlah delapan, kecuali He yang hanya memiliki dua elektron. Menurut mereka, setiap atom dalam pembentukan senyawa membentuk konfigurasi elektron yang stabil, yaitu konfigurasi elektron gas mulia yang disebut konfigurasi oktet. Oleh karena itu, kaidah ini disebut juga kaidah oktet (untuk helium disebut kaidah duplet).
Atom O mempunyai nomor atom 8, sehingga konfigurasi bohrnya menjadi 2 6 (elektron valensi = 6)
Atom C mempunyai nomor atom 6, sehingga konfigurasi bohrnya menjadi 2 4 (elektron valensi = 4)
Sehingga jika digambarkan maka struktur lewis dari kedua atom ketika berikatan menjadi seperti berikut
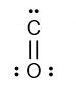
Setiap ikatan rangkap 1 samadengan 1 pasang elektron, untuk ikatan rangkap 2 berarti terdiri dari 2 pasang elektron, sehingga jumlah elektron disekitar atom C ada 6 elektron dan di atom O ada 8 elektron. Oleh karena itu bisa disimpulkan bahwa senyawa CO tidak memenuhi aturan oktet.
Atom I dan Cl merupakan golongan VIIA sehingga mempunyai elektron valensi 7. Jika mereka berikatan menjadi senyawa ICl3maka struktur lewisnya seperti berikut:
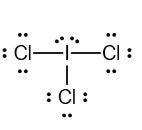
Karena setiap ikatan rangkap 1 terdapat 1 pasang elektron, maka bisa disimpulkan bahwa elektron disekitar atom I ada 10 atau tidak memenuhi kaidah oktet.
Jadi, kesimpulannya senyawa CO dan ICl3 tidak memenuhi kaidah oktet karena elektron yang berada disekitar inti tidak samadengan 8

















