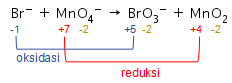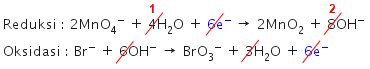Iklan
Pertanyaan
Ion bromida ( Br − ) direaksikan dengan ion permanganat ( MnO 4 − ) dalam medium basa. Reaksi tersebut menghasilkan ion bromat ( BrO 3 − ) dan mangan (IV) oksida ( MnO 2 ) . Perbandingan koefisien reduktor dan oksidator pada reaksi tersebut adalah ....
Ion bromida direaksikan dengan ion permanganat dalam medium basa. Reaksi tersebut menghasilkan ion bromat dan mangan (IV) oksida . Perbandingan koefisien reduktor dan oksidator pada reaksi tersebut adalah ....
1 : 2
2 : 1
4 : 6
3 : 6
2 : 3
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia