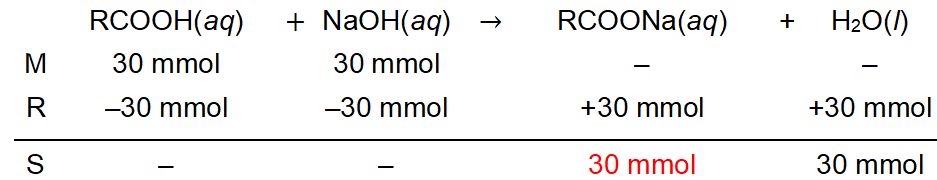Iklan
Pertanyaan
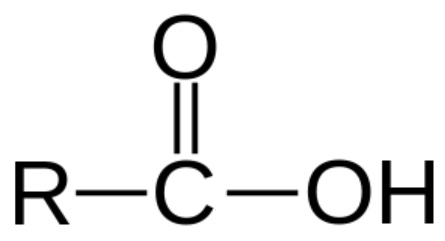
Informasi berikut digunakan untuk menjawab soal. Seorang laboran akan membuat larutan dengan cara mencampurkanlarutan Xdenganlarutan NaOH dalam gelas kimia. Volume dan konsentrasi dari masing-masing reaktan adalah sama, yaitu 100 mL dan 0,3 M. Diketahui bahwa larutan X diperoleh dari oksidasi larutan Y yang memberikan hasil positif dengan pereaksi Tollens. Jika larutan X memiliki tetapan ionisasi sebesar 1 , 2 × 1 0 − 5 , pH larutan setelah pencampuran adalah ....
Informasi berikut digunakan untuk menjawab soal.
Seorang laboran akan membuat larutan dengan cara mencampurkan larutan X dengan larutan NaOH dalam gelas kimia. Volume dan konsentrasi dari masing-masing reaktan adalah sama, yaitu 100 mL dan 0,3 M. Diketahui bahwa larutan X diperoleh dari oksidasi larutan Y yang memberikan hasil positif dengan pereaksi Tollens.
Jika larutan X memiliki tetapan ionisasi sebesar , pH larutan setelah pencampuran adalah ....
Iklan
I. Solichah
Master Teacher
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia