Iklan
Pertanyaan
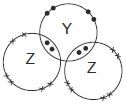
Berikut ini adalah diagram elektron valensi pada molekul YZ 2 . Unsur Y dan Z adalah . . . .
Berikut ini adalah diagram elektron valensi pada molekul . Unsur Y dan Z adalah . . . .
Argon dan kripton
Kalsium dan klor
Belerang dan klor
Oksigen dan hidrogen
Karbon dan oksigen
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
4
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia