Iklan
Pertanyaan
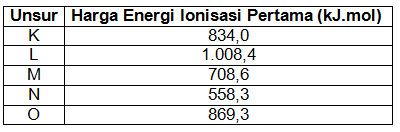
Harga energi ionisasi pertama unsur–unsur dalam satu periode disajikan dalam tabel berikut. Berdasarkan data dalam tabel tersebut, urutan unsur–unsur dalam satu periode dari kiri ke kanan adalah …
Harga energi ionisasi pertama unsur–unsur dalam satu periode disajikan dalam tabel berikut.
Berdasarkan data dalam tabel tersebut, urutan unsur–unsur dalam satu periode dari kiri ke kanan adalah …
K, L, M, O, dan N
L, O, K, M, dan N
M, K, O, L, dan N
N, M, K, O dan L
O, K, M, N, dan L
Iklan
SL
S. Lubis
Master Teacher
Mahasiswa/Alumni Universitas Sumatera Utara
Jawaban terverifikasi
18
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia