Energi ionisasi adalah nilai energi minimum yang diperlukan atom netral dalam wujud gas untuk melepas sebuah elektron paling luar (yang terikat paling lemah) membentuk ion positif. Pelepasan elektron kedua (dari ion positif satu) disebut energi ionisasi kedua, pelepasan elektron ketiga disebut energi ionisasi ketiga, dan seterusnya. Harga energi ionisasi dipengaruhi oleh jari-jari atom dan jumlah elektron valensi atau muatan inti.
Dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil. Hal itu terjadi karena dalam satu golongan makin ke bawah jari-jari atom makin besar sehingga gaya tarik inti terhadap elektron terluar makin lemah. Makin lemah gaya tarikan inti, makin mudah pula elektron dilepaskan. Dengan demikian, dalam satu golongan, besar energi ionisasi ditentukan oleh jumlah kulit atom. Dalam satu periode, dari kiri ke kanan, energi ionisasi makin besar. Hal itu terjadi karena dalam satu periode, semakin ke kanan jumlah proton dan elektron makin banyak. Sementara antara proton dan elektron ada gaya tarik-menarik. Adanya gaya tarik-menarik itu menyebabkan elektron terluar makin sulit untuk dilepaskan. Dengan demikian, dalam satu periode, besar energi ionisasi ditentukan oleh jumlah proton dan elektron.
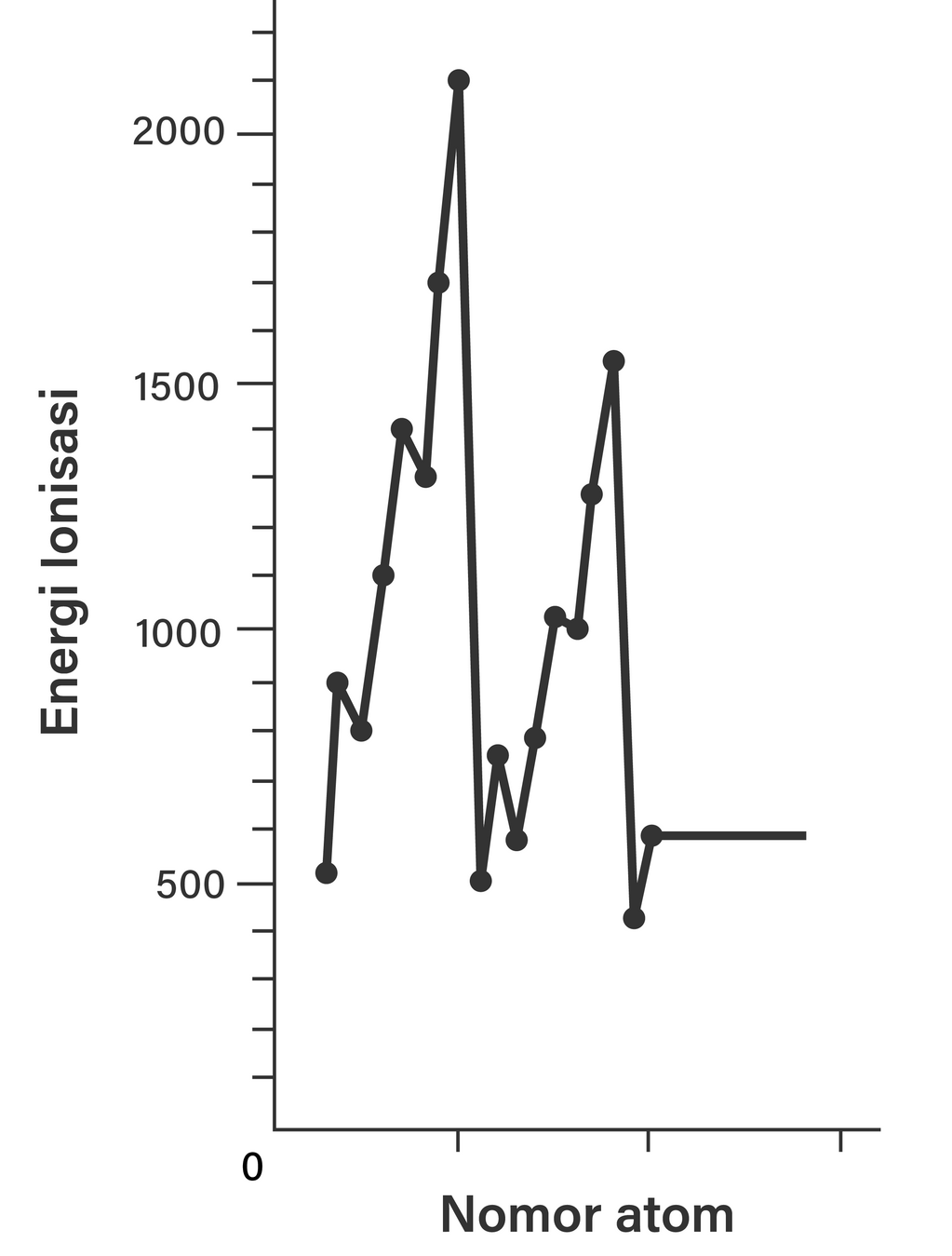
Berdasarkan gambar di atas, terlihat bahwa terdapat 2 buah unsur yang terdapat pada titik-titik puncak utama. Kedua unsur ini merupakan unsur yang memiliki energi ionisasi terbesar. Energi ionisasi yang besar bergantung pada banyaknya elektron valensi atau elektron terluar, serta jumlah kulit elektron. Jumlah elektron terluar yang banyak dan jumlah kulit elektron yang sedikit akan menyebabkan elektron sulit dilepaskan yang menyebabkan energi ionisasi bernilai besar. Unsur-unsur yang terletak pada golongan VIII A memiliki 8 buah elektron pada kulit terluar, maka unsur-unsur golongan VIII A memiliki nilai energi ionisasi yang besar jika dibandingkan dengan unsur-unsur dari golongan lainnya. Unsur golongan VIII A yang terletak pada periode 1, 2, dan 3 akan memiliki energi ionisasi terbesar jika dibandingkan dengan unsur-unsur dari golongan lain pada periode yang sama.
Dengan demikian, maka unsur yang terdapat pada titik-titik puncak utama adalah Ne dan Ar.
Jadi, jawaban yang tepat adalah B.