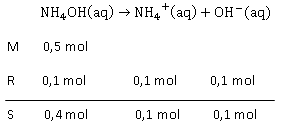Iklan
Pertanyaan
Gas NH 3 sebanyak 1 mol dilarutkan ke dalam air sehingga volume larutan menjadi 2 L. Pada saat setimbang setelah terionisasi diperoleh jumlah ion OH − sebanyak 0,1 mol. Tentukanlah: derajat ionisasinya ( α ) konstanta kesetimbangan basa ( K b )
Gas sebanyak 1 mol dilarutkan ke dalam air sehingga volume larutan menjadi 2 L. Pada saat setimbang setelah terionisasi diperoleh jumlah ion sebanyak 0,1 mol. Tentukanlah:
- derajat ionisasinya ()
- konstanta kesetimbangan basa ()
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
6
5.0 (3 rating)
MJ
Mayang Julion
Mudah dimengerti
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia