Ikatan kovalen merupakan ikatan yang terjadi karena pemakaian bersama pasangan elektron. Pasangan elektron ini dapat berasal dari masing-masing atom yang saling berikatan. Ikatan yang terbentuk disebut sebagai ikatan kovalen. Apabila pasangan elektron yang digunakan hanya berasal dari salah satu atom yang berikatan, maka ikatan yang terbentuk disebut dengan ikatan kovalen koordinasi.
Untuk menggambarkan bagaimana ikatan kovalen terjadi, digunakan rumus titik elektron (struktur Lewis). Struktur Lewis merupakan penggambaran distribusi elektron dalam suatu struktur molekul dengan menggunakan tanda elektron. Struktur ini menggambarkan bagaimana peranan elektron valensi dalam membentuk ikatan.
Struktur Lewis dibuat dengan gambaran suatu atom beserta elektron valensinya, untuk menentukan elektron valensi, maka perlu dibuat konfigurasi elektronnya. Senyawa sulfur dioksida (SO2) terdiri atas 2 jenis unsur, yaitu unsur belerang (S) sebagai atom pusat dan oksigen (O) yang akan terikat pada atom pusat. Konfigurasi elektron dari kedua unsur tersebut adalah sebagai berikut.
8O=1s2 2s2 2p416S=1s2 2s2 2p6 3s2 3p4
Berdasarkan konfigurasi elektronnya, dapat diketahui bahwa baik unsur S maupun O memiliki elektron valensi yang sama, yaitu sebanyak 6 elektron. Kemudian kedua atom tersebut dibuat struktur Lewisnya sebagai berikut.

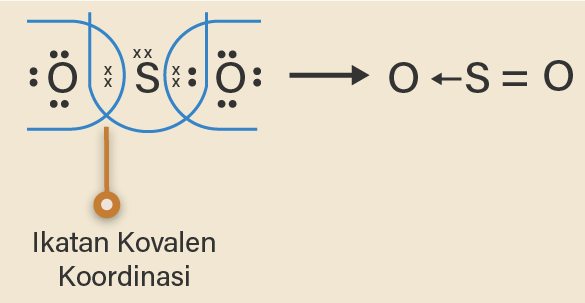
Berdasarkan gambar di atas, terlihat bahwa pada ikatan atom S dan O dalam senyawa SO2 terdapat ikatan kovalen koordinasi, dimana salah satu atom O menggunakan sepasang elektron yang berasal dari atom S untuk berikatan. Jika atom O dan atom S masing-masing memberikan pasangan elektron untuk digunakan bersama, maka atom S tidak akan memenuhi kaidah oktet (8 elektron) karena jumlah elektronnya menjadi lebih dari 8 elektron.
Dengan demikian, maka pada senyawa sulfur dioksida (SO2) terdapat ikatan kovalen biasa dan sebuah ikatan kovalen koordinasi.
Jadi, gambar struktur Lewis dari senyawa sulfur dioksida adalah sebagai berikut.