Untuk menentukan bentuk molekul H2O dan SO2, tentukan terlebih dahulu konfigurasi elektron dan elektron valensinya.
1H=1s1 e−val:18O=[He] 2s2 2p4 e−val:616S=[Ne] 3s2 3p4 e−val:6
Kemudian, gambarkan struktur Lewis masing-masing molekul, yaitu struktur yang menggambarkan posisi atom dalam ikatan beserta titik-titik yang menggambarkan elektron valensi atom-atom tersebut.
- Struktur Lewis H2O

- Struktur Lewis SO2

Bentuk molekul dapat diketahui dari tipe molekul dengan format:
AXmEn
dimana m adalah jumlah pasangan elektron ikatan (ikatan rangkap dua dan tiga dianggap 1 PEI), sedangkan n menunjukkan jumlah pasangan elektron bebas.
Karena H2O memiliki 2 pasangan elektron ikatan dan 2 pasangan elektron bebas, tipe molekul H2O adalah AX2E2 yang mewakili bentuk V atau bengkok; dan tipe molekul SO2 adalah AX2E yang juga mewakili bentuk V atau bengkok. Namun keduanya memiliki sudut ikat yang berbeda. Karena H2O memiliki 2 PEB, maka gaya tolak PEB ini lebih kuat dibandingkan pada molekul SO2 yang hanya memiliki sepasang PEB. Akibatnya, sudut ikatan H-O-H lebih kecil dibandingkan sudut ikat O-S-O. Gambar bentuk molekul H2O adalah sebagai berikut:
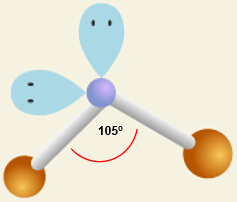
sedangkan bentuk molekul SO2:
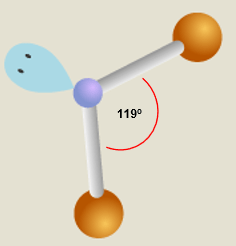
Jadi, keduanya memiliki bentuk molekul sama, yaitu bentuk V, namun dengan sudut ikat berbeda, sudut ikat H2O lebih kecil daripada SO2 karena H2O memiliki PEB lebih banyak daripada SO2.



















