Iklan
Pertanyaan
Energi kisi adalah energi yang dilepas ion-ion dalam bentuk gas membentuk padatan kristalnya. Dimas ingin menghitung energi kisi dari langkah-langkah reaksi NaF , tetapihanya memiliki data reaksi-reaksi NaCl dan juga CaF 2 seperti gambar di bawah. Energi kisi dari NaF ( △ H 0 f NaF = − 575 , 38 kJ / mol ) adalah ....
Energi kisi adalah energi yang dilepas ion-ion dalam bentuk gas membentuk padatan kristalnya. Dimas ingin menghitung energi kisi dari langkah-langkah reaksi , tetapi hanya memiliki data reaksi-reaksi dan juga seperti gambar di bawah.
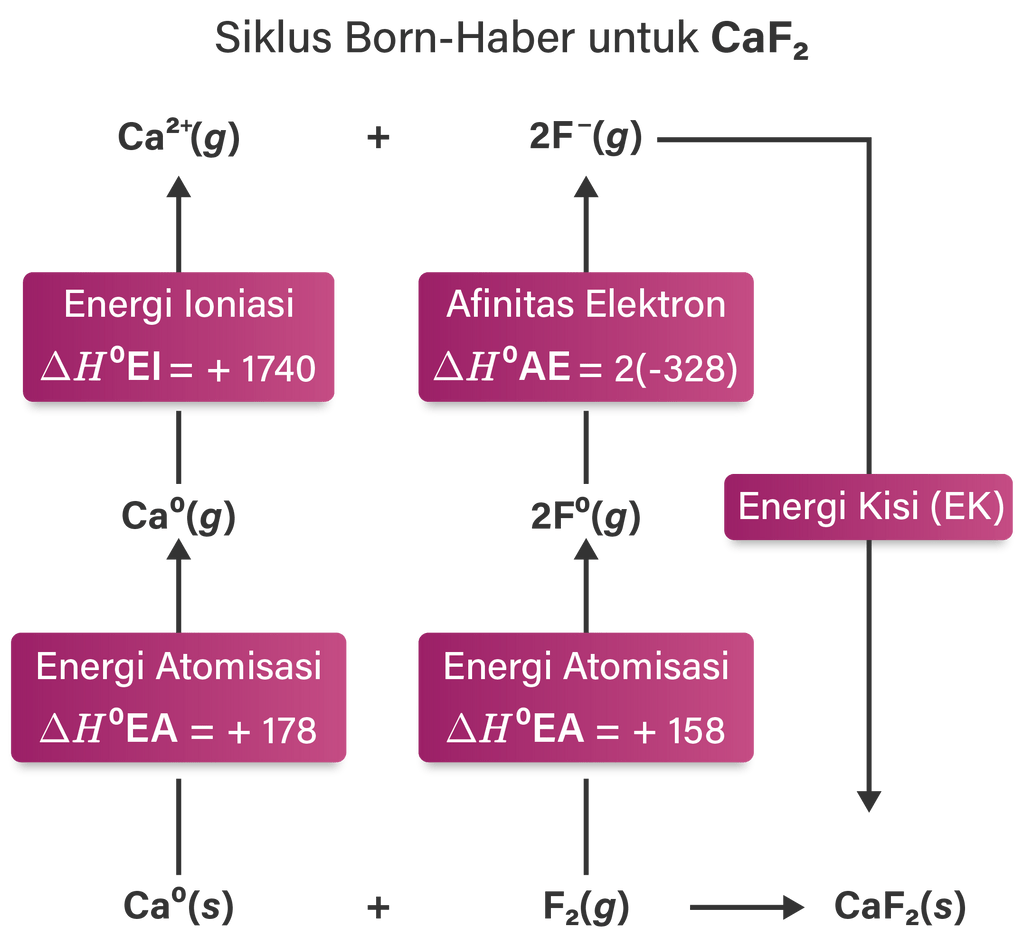
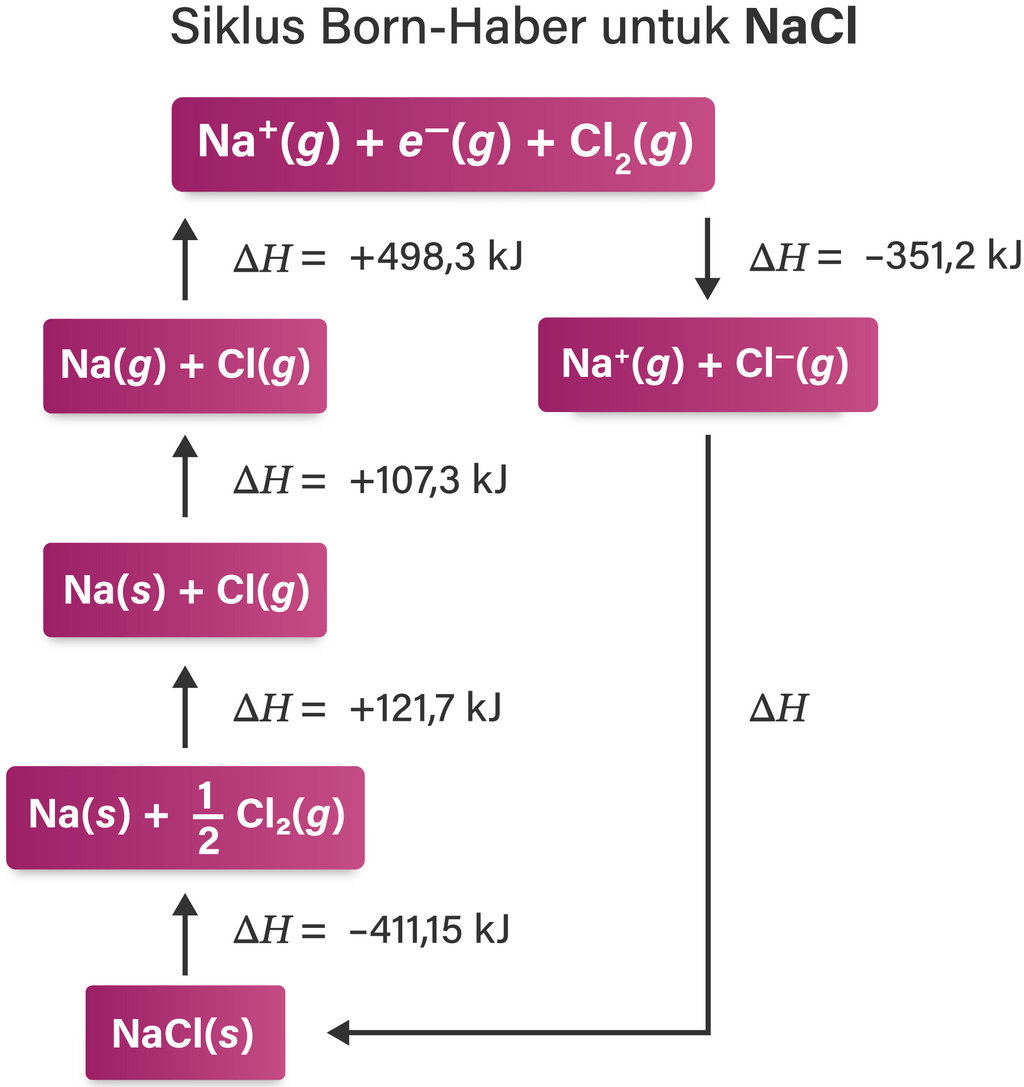
Energi kisi dari adalah ....
931,98 kJ
218,78 kJ
575,38 kJ
603,98 kJ
1010,98 kJ
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
9
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















