Jawaban yang tepat adalah C.
Setiap orbital atom memiliki satu set tiga bilangan kuantum yang unik, antara lain bilangan kuantum utama (n), azimuth (l), dan magnetik (m), dan bilangan kuantum spin (s).
Langkah-langkah menentukan bilangan kuantum:
- Bilangan kuantum utama (n) menyatakan jumlah kulit. Ketentuannya kulit pertama (K) = 1, kulit kedua (L) = 2, dst
- Bilangan kuantum azimuth (l) menunjukkan letak subkulit/orbital (s = 1, p = 2, d = 3, dan f = 4)
- Bilangan Kuantum magnentik (m), menyatakan orbital khusus tempat elektron itu berada serta orientasi orbital dalam ruangan relatif terhadap inti.
l = 0 →m=0l = 1 →m=−1, 0, +1l = 2 →m=−2, −1, 0, +1, +2l = 3 →m=−3, −2, −1, 0, +1, +2, +3
- Bilangan kuantum spin (s) menunjukkan arah putaran elektron dlam orbital. Pada orbital maksimum 2 elektron dengan arah berlawanan. S berharga +21 (searah jarum jam/menghadap keatas) dan −21 (berlawanan jarum jam/menghadap kebawah).
Bilangan kuantum 4p2 adalah n=4, l=1, pada bilangan kuantum magnetik, subkulit p memiliki 3 ruang yang dapat diisi oleh masing-masing 2 elektron tiap ruang. Untuk tingkat energi 4p2 artinya dalam subkulit p terdapat 2 elektron. Posisi elektronya sebagai berikut:
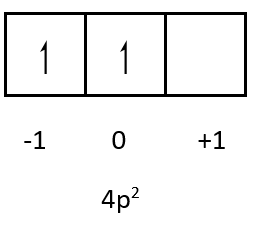
Bilangan kuantum magnetik untuk 4p2 adalah 0 dan bilangan kuantum spin-nya adalah +21(panah menghadap keatas).
Bilangan kuantum 4p2 adalah n=4, l=1, m=0, s=+21
















