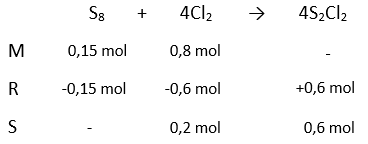Iklan
Pertanyaan
Disulfur diklorida digunakan dalam vulkanisasi karet, yaitu suatu proses pencampuran belerang dengan karet untuk menghasilkan karet yang lebih keras teksturnya, tahan lama, dan elastis. Senyawa ini dibuat dengan cara memanaskan sulfur dengan gas klorin melalui reaksi berikut (belum setara): S 8 ( l ) + Cl 2 ( g ) → S 2 Cl 2 ( l ) Jika reaksi antara 38,4 g sulfur dengan 56,8 g gas klorin menghasilkan 64,8 g disulfur diklorida maka rendemen yang dihasilkan pada reaksi tersebut sebanyak . . . . ( A r S = 32 ; Cl = 35 , 5 ) .
Disulfur diklorida digunakan dalam vulkanisasi karet, yaitu suatu proses pencampuran belerang dengan karet untuk menghasilkan karet yang lebih keras teksturnya, tahan lama, dan elastis. Senyawa ini dibuat dengan cara memanaskan sulfur dengan gas klorin melalui reaksi berikut (belum setara):
Jika reaksi antara 38,4 g sulfur dengan 56,8 g gas klorin menghasilkan 64,8 g disulfur diklorida maka rendemen yang dihasilkan pada reaksi tersebut sebanyak . . . . .
Iklan
A. Muhammad
Master Teacher
Mahasiswa/Alumni Universitas Pendidikan Indonesia
34
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia