Iklan
Pertanyaan
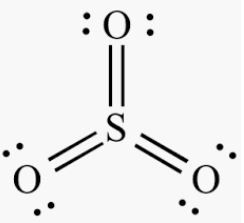
Diketahui unsur S terletak pada golongan VIA dan unsur O memiliki nomor atom 8. Jika kedua unsur saling berikatan, akan membentuk senyawa SO 3 . Hal-halyang tepat mengenai molekul SO 3 adalah ... memiliki ikatan kovalen koordinasi memiliki bentuk molekul segitiga datar memiliki gaya dipol-dipol antar molekulnya bersifat nonpolar
Diketahui unsur S terletak pada golongan VIA dan unsur O memiliki nomor atom 8. Jika kedua unsur saling berikatan, akan membentuk senyawa . Hal-hal yang tepat mengenai molekul adalah ...
- memiliki ikatan kovalen koordinasi
- memiliki bentuk molekul segitiga datar
- memiliki gaya dipol-dipol antar molekulnya
- bersifat nonpolar
1, 2, dan 3 SAJA jawaban yang benar.
1 dan 3 SAJA jawaban yang benar.
2 dan 4 SAJA jawaban yang benar.
HANYA 4 yang benar.
SEMUA pilihan benar.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia