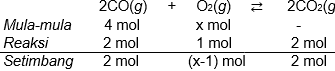Iklan
Pertanyaan
Diketahui reaksi kesetimbangan: 2 CO ( g ) + O 2 ( g ) ⇌ 2 CO 2 ( g ) Pada suhu tertentu, 4 mol gas CO direaksikan dengan gas O 2 , ternyata dalam kesetimbangan terdapat 2 mol gas . Jika volume ruangan 10 liter dan harga K c = 4 , berapa mol gas yang diperlukan dalam reaksi tersebut?
Diketahui reaksi kesetimbangan:
Pada suhu tertentu, 4 mol gas direaksikan dengan gas , ternyata dalam kesetimbangan terdapat 2 mol gas . Jika volume ruangan 10 liter dan harga , berapa mol gas
yang diperlukan dalam reaksi tersebut?
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
4
4.3 (13 rating)
Am
Ahmad munsif f
Pembahasan lengkap banget Ini yang aku cari! Bantu banget Makasih ❤️ Mudah dimengerti
AD
Aurelya Dewi Anggreini Pandiangan
Makasih ❤️
ER
EKA RUSDIANA
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia