Iklan
Pertanyaan
Diketahui profil reaksi kesetimbangan fase gas antara X , Y , dan Z pada suhu tertentu sebagai berikut. Jika pada saat t = 7 s , volume sistem diperbesar, mana pernyataan berikut yang benar?
Diketahui profil reaksi kesetimbangan fase gas antara , , dan pada suhu tertentu sebagai berikut.
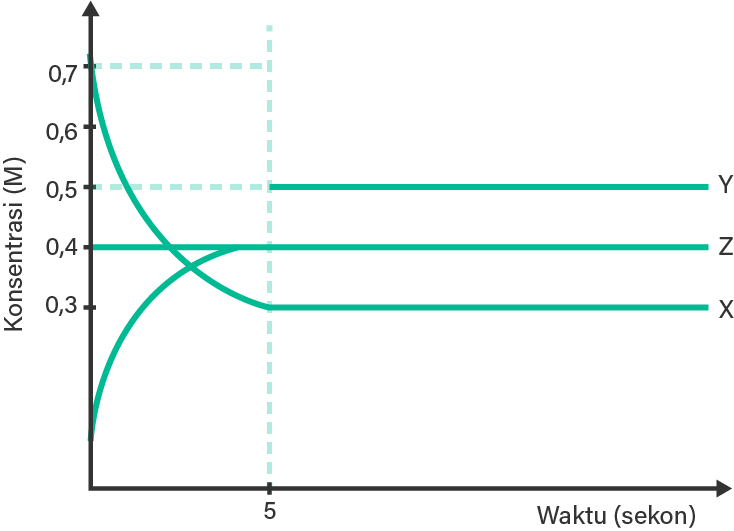
Jika pada saat , volume sistem diperbesar, mana pernyataan berikut yang benar?
bertambah, bertambah.
berkurang, bertambah.
tetap, tetap, tetap.
berkurang, bertambah.
berkurang, berkurang.
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia