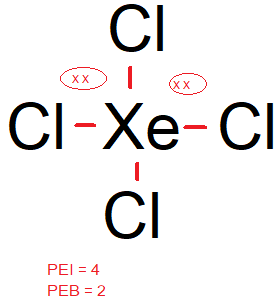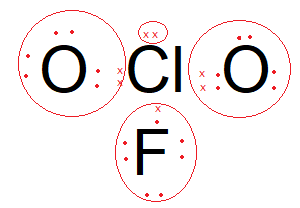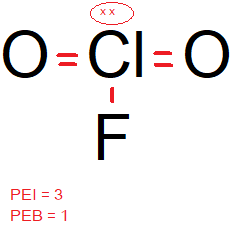Iklan
Pertanyaan
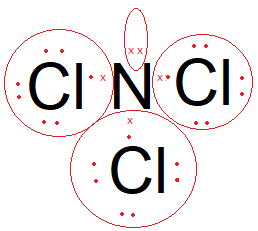
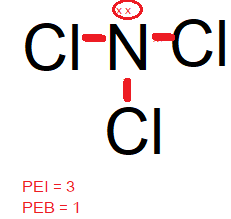
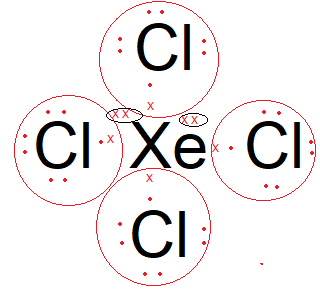
Diketahui nomor atom N = 7, O= 8, F = 9, Si = 14, Cl = 17, dan Xe = 54. Molekul berikut yang bersifat polar adalah ... NCI 3 XeCl 4 ClO 2 F SiCl 4
Diketahui nomor atom N = 7, O = 8, F = 9, Si = 14, Cl = 17, dan Xe = 54. Molekul berikut yang bersifat polar adalah ...
- NCI3
- XeCl4
- ClO2F
- SiCl4
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
8
3.0 (4 rating)
AC
Aurellia Carissa Amalia
Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia