Iklan
Pertanyaan
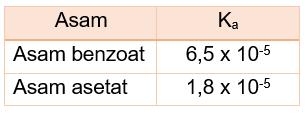
Diketahui nilai tetapan ionisasi asam ( K a ) dari asam benzoat dan asam asetat sebagai berikut. Perhatikan beberapa pernyataan berikut! Kedua asam merupakan asam lemah. Asam benzoat merupakan asam yang lebih kuat daripada asam asetat. Pada konsentrasi yang sama, asam benzoat mempunyai pH lebih besar daripada asam asetat. Pernyataan yang benar ditunjukkan oleh nomor ...
Diketahui nilai tetapan ionisasi asam dari asam benzoat dan asam asetat sebagai berikut.
Perhatikan beberapa pernyataan berikut!
- Kedua asam merupakan asam lemah.
- Asam benzoat merupakan asam yang lebih kuat daripada asam asetat.
- Pada konsentrasi yang sama, asam benzoat mempunyai pH lebih besar daripada asam asetat.
Pernyataan yang benar ditunjukkan oleh nomor ...
1
2
3
1 dan 2
1, 2, dan 3
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
3
4.7 (9 rating)
NS
Niluh Sayu
Makasih ❤️
Iklan
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia