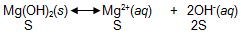Massa kelarutan Mg(OH)2 dalam 100 mL NaOH 0,05 M adalah 4,18×10−8 gram.
Kelarutan (S) digunakan untuk menyatakan jumlah maksimum zat yang dapat larut dalam sejumlah tertentu zat pelarut atau larutan.
Dalam larutan jenuh Mg(OH)2 terdapat kesetimbangan antara Mg(OH)2 padat dengan ion Mg2+ dan ion OH− dalam larutan sesuai persamaan reaksi berikut:
Mg(OH)2(s)⇌Mg2+(aq)+OH−(aq)
Hubungan kelarutan (S) dan tetapan hasil kelarutan untuk Mg(OH)2 adalah sebagai berikut:
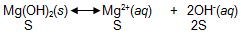
Untuk mengetahui massa kelarutan Mg(OH)2 dalam 100 mL larutan NaOH 0,05 M, perlu dihitung dengan cara berikut:
1. Menghitung konsentrasi ion senama 
Ion senama (OH−) akan memperkecil kelarutan, tetapi tidak mempengaruhi harga tetapan hasil kali kelarutan asalkan suhu tidak berubah.

Ion OH− = 2S + 0,05 M, namun karena jumlah ion OH− dari Mg(OH)2 jauh lebih kecil daripada ion OH− dari NaOH, jumlah ion OH− yang digunakan dalam perhitungan adalah jumlah ion OH− yang berasal dari NaOH saja, yaitu 0,05 M.
2. Menghitung kelarutan Mg(OH)2 dalam larutan NaOH
Ksp Mg(OH)21,8×10−11SS====[Mg2+]×[OH−]2S×(0,05)2 (0,05)21,8×10−117,2×10−9
3. Menghitung mol Mg(OH)2 dalam 100 mL NaOH
mol Mg(OH)2 dalam NaOH===volume NaOH×kelarutan Mg(OH)2 dalam NaOH0,1 L×7,2×10−9 mol/L7,2×10−10 mol
4. Menghitung massa kelarutan Mg(OH)2 dalam 100 mL NaOH
massa Mg(OH)2 dalam NaOH ===mol×Mr Mg(OH)27,2×10−10 mol×58 gr/mol4,18×10−8 gr
Dari perhitungan di atas, dapat diketahui bahwa massa kelarutan Mg(OH)2 dalam 100 mL NaOH 0,05 M adalah 4,18×10−8 gram.