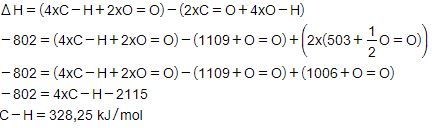Iklan
Pertanyaan
Diketahui: Energi ikatan rata-rata H − H = 436 kJ mol − 1 Energi atomisasi C ( s ) → C ( g ) △ H = + 715 kJ Tentukan energi ikatan C − H pada CH 4 .
Diketahui:
Energi ikatan rata-rata
Energi atomisasi
Tentukan energi ikatan pada .
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
6
4.5 (16 rating)
0
000000000000000000000000ca6082a54b8b16bda7c007f57853264ee5ee2bd8c86c
Pembahasan lengkap banget
CS
Cinda Safa
Mudah dimengerti Pembahasan lengkap banget Ini yang aku cari! Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia