Iklan
Pertanyaan
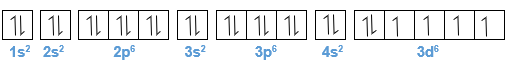
Diketahui atom besi mempunyai nomor atom 26. Tuliskan konfigurasi elektron atom besi. Ada berapa orbital yang terisi elektron? Ada berapa orbital yang terisi elektron tidak berpasangan? Bagaimana konfigurasi elektron dari ion Fe 3 + ?
Diketahui atom besi mempunyai nomor atom 26.
- Tuliskan konfigurasi elektron atom besi.
- Ada berapa orbital yang terisi elektron?
- Ada berapa orbital yang terisi elektron tidak berpasangan?
- Bagaimana konfigurasi elektron dari ion ?
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
11
3.2 (8 rating)
AD
Amelia Duwiyanti
Makasih ❤️
PU
Putri Utami
Jawaban tidak sesuai
NV
Novellies Vida Padmani
Jawaban tidak sesuai
mj
miftahul janna
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia