Mula-mula, tuliskan konfigurasi elektron dari atom menurut aturan Aufbau. Pada aturan Aufbau, pengisian elektron dimulai dari orbital dengan energi yang lebih rendah, yaitu dengan urutan 1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s - dst. Setiap subkulit dapat diisi maksimum elektron:
- Subkulit s memiliki 1 orbital, maksimum diisi 2 elektron.
- Subkulit p memiliki 3 orbital, maksimum diisi 6 elektron.
- Subkulit d memiliki 5 orbital, maksimum diisi 10 elektron.
- Subkulit f memiliki 7 orbital, maksimum diisi 14 elektron.
Atom memiliki nomor atom 42, berarti jumlah elektronnya sebanyak 42. Konfigurasi elektronnya:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d4
Konfigurasi tersebut tidak terlalu disukai. Elektron-elektron dalam orbital d lebih stabil ketika subkulit d terisi setengah penuh atau penuh sehingga konfigurasi yang stabil adalah:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5
Selanjutnya, pengisian orbital dilakukan menurut aturan Hund, yaitu setiap orbital diisi elektron dengan spin yang sama dahulu, baru kemudian diisi elektron dengan spin berbeda. Diagram orbital:
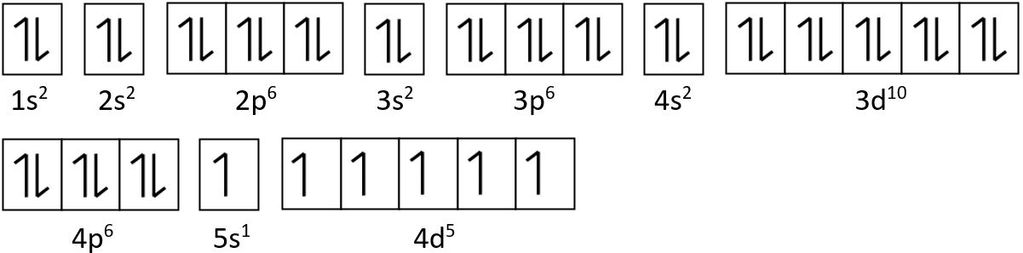
Dari diagram orbital tersebut terlihat bahwa jumlah orbital yang ditempati pasangan elektron sebanyak 18 orbital.
Jadi, jawaban yang tepat adalah E.
















