Menurut teori medan kristal, orbital d atom pusat dapat mengalami pembelahan (splitting) energi. Pembelahan terjadi akibat adanya gaya elektrostatik antara ion logam dengan ligan. Pembelahan orbital d bergantung pada ketepatan orientasi ligan dengan orientasi kelima orbital d.
Orbital dz2 dan dx2−y2 (disebut sebagai orbital eg) terletak tepat di sumbu x, y, dan z. Sedangkan orbital dxy, dxz, dan dyz (disebut sebagai orbital t2g) terletak di antara sumbu x, y, dan z. Ketika ion kompleks terbentuk, kelima orbital d memiliki tingkat energi yang lebih tinggi daripada tingkat energi kelima orbital d dalam ion logam bebas karena adanya gaya tolak dari ligan-ligan yang mendekatinya.
Pengisian elektron dalam orbital d dipengaruhi oleh ligan melalui dua cara berikut:
- Ligan medan lemah dan kompleks spin tinggi.
Ligan medan lemah menyebabkan pemecahan energi yang kecil. Oleh karena itu, energi yang diperlukan oleh elektron d untuk lompat ke orbital eg lebih kecil daripada energi yang diperlukan untuk berpasangan dalam orbital t2g (Epemasangan>△pembelahan). Hasilnya, ion kompleks memiliki jumlah elektron tak berpasangan yang maksimum (kompleks spin tinggi), sama dengan yang terdapat dalam ion logam bebas. Contoh ligan lemah adalah F−, Cl−, Br−, H2O, OH−, SCN−, C2O42−.
- Ligan medan kuat dan kompleks spin rendah.
Ligan medan kuat menyebabkan pemecahan energi orbital d yang besar sehingga energi yang diperlukan oleh elektron-elektron untuk lompat ke orbital eg lebih besar daripada energi yang diperlukan untuk berpasangan dalam orbital t2g (Epemasangan<△pembelahan). Oleh karena itu, ligan medan kuat membentuk kompleks spin rendah dengan jumlah elektron tak berpasangan dalam ion kompleks lebih sedikit daripada yang terdapat dalam ion logam bebas. Contoh ligan kuat adalah CN−, NH3, CO, P(CH3)3.
Sifat magnetik senyawa kompleks ditentukan oleh elektron tak berpasangan. Semakin banyak elektron tak berpasangan, semakin paramagnetik ion kompleks atau logam transisi. Dengan kata lain ion kompleks dengan ligan lemah yang membentuk kompleks spin tinggi lebih paramagnetik dibanding ion kompleks dengan ligan tinggi yang membentuk kompleks spin rendah.
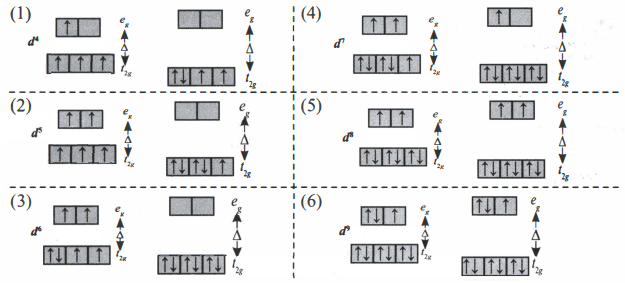
Pada diagram orbital diatas, diagram orbital (1), (2), (3), dan (4) menunjukkan ion kompleks dengan ligan lemah lebih paramagnetik (sebelah kiri) dibandingkan ion kompleks dengan ligan kuat (sebelah kanan) karena memiliki jumlah elektron tak berpasangan yang lebih banyak.
Jadi, semakin banyak elektron tak berpasangan pada orbital, semakin paramagnetik sifat ion kompleksnya.