Reaksi yang termasuk oksidasi dan reduksi ditunjukkan pada gambar di bawah ini.
Berdasarkan konsep perubahan bilangan oksidasi, oksidasi adalah peristiwa kenaikan bilangan oksidasi dan reduksi adalah peristiwa penurunan bilangan oksidasi.
Untuk menentukan perubahan bilangan oksidasi dapat menggunakan aturan sebagai berikut:
- Bilangan oksidasi unsur bebas adalah nol (0).
- Bilangan oksidasi ion monoatom sama dengan muatan ionnya.
- Jumlah bilangan oksidasi untuk semua atom dalam senyawa adalah nol (0).
- Jumlah bilangan oksidasi atom-atom pembentuk ion poliatom sama dengan muatan ion poliatom tersebut.
- Bilangan oksidasi unsur-unsur golongan IA dalam senyawanya adalah +1, sedangkan bilangan oksidasi unsur-unsur golongan IIA adalah +2.
- Bilangan oksidasi unsur-unsur golongan VIIA adalah -1.
- Bilangan oksidasi hidrogen dalam senyawanya adalah +1, kecuali dalam hidrida, hidrogen mempunyai bilangan oksidasi -1.
- Bilangan oksidasi oksigen dalam senyawanya adalah -2, kecuali dalam peroksida (biloks oksigen = -1), superoksida (biloks oksigen = -1/2), dan senyawa biner fluorida (biloks oksigen = +2).
Dari aturan tersebut, maka perubahan bilangan oksidasi pada reaksi yang dituliskan dalam soal dapat digambarkan seperti di bawah ini.
Reaksi 1:
♦ Biloks Cl dalam Cl2 (unsur bebas) = 0
♦ Biloks Cl dalam Cl2O3
2×biloks Cl+3×biloks O2×biloks Cl+3×(−2)2×biloks Cl+(−6)2×biloks Clbiloks Cl=====biloks Cl2O300+6+3
♦ Biloks O dalam O2 (unsur bebas) = 0
♦ Biloks O dalam Cl2O3 = -2
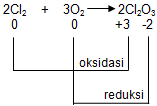
Dari gambar di atas, dapat diketahui bahwa Cl mengalami kenaikan bilangan oksidasi dari 0 menjadi +3 (oksidasi) dan O mengalami penurunan bilangan oksidasi dari 0 menjadi -2 (reduksi) sehingga reaksi tersebut merupakan reaksi redoks.
Reaksi 2:
♦ Biloks Cr dalam Cr2O3
2×biloks Cr+3×biloks O2×biloks Cr+3×(−2)2×biloks Cr+(−6)2×biloks Crbiloks Cr=====biloks Cr2O300+6+3
♦ Biloks Cr dalam unsur bebas = 0
♦ Biloks Al dalam unsur bebas = 0
♦ Biloks Al alam Al2O3
2×biloks Al+3×biloks O2×biloks Al+3×(−2)2×biloks Al+(−6)2×biloks Albiloks Al=====biloks Cr2O300+6+3
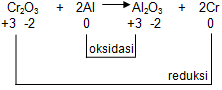
Dari gambar di atas, dapat diketahui bahwa Cr mengalami penurunan bilangan oksidasi dari +3 menjadi 0 (reduksi) dan Al mengalami kenaikan bilangan oksidasi dari 0 menjadi +3 (oksidasi) sehingga reaksi tersebut merupakan reaksi oksidasi.

















