Iklan
Pertanyaan
Data percobaan penurunan titik beku: Berdasarkan data tersebut apa yang dapat anda simpulkan?
Data percobaan penurunan titik beku:
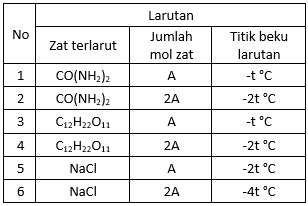
Berdasarkan data tersebut apa yang dapat anda simpulkan?
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
25
4.7 (4 rating)
NY
Nanda Yessi
Pembahasan lengkap banget
N
Nurhildatullah
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















