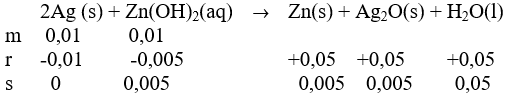Iklan
Pertanyaan
Dalam suatu tabung terjadi reaksi sebagai berikut. 2 Ag ( s ) + Zn ( OH ) 2 ( a q ) → Zn ( s ) + Ag 2 O ( s ) + H 2 O ( l ) Pada reaksi tersebut, digunakan 0,01 mol logam perak dan 50 mL larutan Zn ( OH ) 2 yang diperoleh dari pengenceran 10 mL 1 M. Jika reaksi berlangsung stoikiometri dan sempurna, massa Zn (Ar Zn = 65,5) yang terbentuk dalam reaksi di atas adalah ...
Dalam suatu tabung terjadi reaksi sebagai berikut.
Pada reaksi tersebut, digunakan 0,01 mol logam perak dan 50 mL larutan yang diperoleh dari pengenceran 10 mL 1 M. Jika reaksi berlangsung stoikiometri dan sempurna, massa Zn (Ar Zn = 65,5) yang terbentuk dalam reaksi di atas adalah ...
65,4 mg
327 mg
450 mg
580 mg
1160 mg
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
5
5.0 (4 rating)
NP
Nabila Puspita
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia