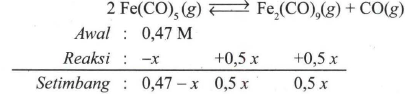Iklan
Pertanyaan
Besi karbonil, Fe ( CO ) 5 adalah gas yang dalam wadah tertutup dapat terurai sesuai dengan persamaan reaksi kesetimbangan berikut ini: 2 Fe ( CO ) 5 ( g ) ⇌ Fe 2 ( CO ) 9 ( g ) + CO ( g ) Ke dalam suatu wadah dimasukan sejumlah sehingga konsentrasinya 0,47 M. Bila nilai K c untuk reaksi tersebut pada 298 K adalah 9, maka: a. Berapa atmosfir tekanan awal gas dalam wadah tertutup tersebut? (Diketahui R = 0 , 082 L atm mol − 1 K − 1 ) b. Tentukanlah konsentrasi gas Fe 2 ( CO ) 9 dalam keadaan kesetimbangan. c. Tentukanlah nilai K p reaksi tersebut. d.Tentukanlah tekanan total gas sesudah tercapai kesetimbangan.
Besi karbonil, adalah gas yang dalam wadah tertutup dapat terurai sesuai dengan persamaan reaksi kesetimbangan berikut ini:
Ke dalam suatu wadah dimasukan sejumlah sehingga konsentrasinya 0,47 M. Bila nilai untuk reaksi tersebut pada 298 K adalah 9, maka:
a. Berapa atmosfir tekanan awal gas dalam wadah tertutup tersebut?
(Diketahui )
b. Tentukanlah konsentrasi gas dalam keadaan kesetimbangan.
c. Tentukanlah nilai reaksi tersebut.
d. Tentukanlah tekanan total gas sesudah tercapai kesetimbangan.
Iklan
S. Lubis
Master Teacher
1
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia