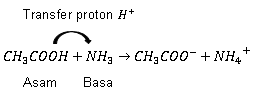Teori asam basa menurut para ahli yaitu:
1. Teori asam basa Arrhenius
"Asam adalah suatu senyawa yang jika dilarutkan ke dalam air akan memberikan ion hidrogen (H+) dalam suatu larutan, basa adalah senyawa yang jika dilarutkan ke dalam air akan memberikan ion hidroksida (OH−) dalam suatu larutan." Dalam hal ini, pembawa sifat asam adalah ion H+ dan pembawa sifat basa adalah ion OH−.
2. Teori asam basa Bronsted-Lowry
Asam : spesi yang dapat memberikan proton atau donor proton (H+)
Basa : spesi yang dapat menerima proton atau akseptor (H+)
3. Teori asam basa Lewis
Asam : spesi yang bertindak sebagai penerima pasangan elektron (akseptor elektron)
Basa : spesi yang bertindak sebagai pemberi pasangan elektron (donor elektron)
Contoh larutan yang dapat menjelas ketiga teori asam basa tersebut adalah :
CH3COOH+NH3→CH3COO−+NH4+
Asam Basa Arrhenius
CH3COOH adalah asam karena dapat menghasilkan ion H+ saat dilarutkan dalam air.
CH3COOH→H++CH3COO−CH3COOH+H2O→H3O++CH3COO−
NH3 adalah basa karena dapat menghasilkan ion OH− saat dilarutkan dalam air.
NH3+H2O→NH4OHNH4OH→NH4++OH−
Asam Basa Bronsted Lowry
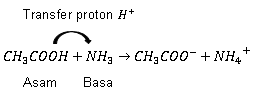
CH3COOH sebagai asam karena mendonorkan proton ke NH3. Sedangkan NH3 sebagai basa karena menerima proton.
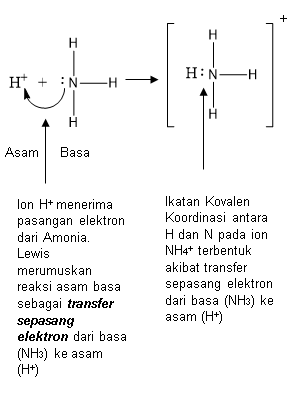
Asam Basa Lewis
NH3 sebagai basa karena mendonorkan pasangan elektron bebas membentuk NH4+, dan CH3COOH adalah asam karena menerima pasangan elektron.
Jadi, contoh asam dan basa yang dapat menjelaskan ketiga teori asam basa adalah CH3COOH dan NaOH.