Iklan
Iklan
Pertanyaan
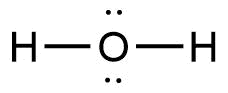
Berikan contoh dua unsur yang dapat membentuk ikatan kovalen. Jelaskan alasan mengapa kedua unsur tersebut yang Anda pilih. Bagaimana struktur Lewis dari senyawa tersebut?
Berikan contoh dua unsur yang dapat membentuk ikatan kovalen.
- Jelaskan alasan mengapa kedua unsur tersebut yang Anda pilih.
- Bagaimana struktur Lewis dari senyawa tersebut?
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
31
0.0 (0 rating)
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia