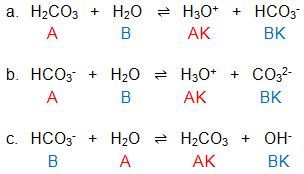Iklan
Pertanyaan
Berdasarkan reaksi-reaksi dibawah ini. a. H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 − b. HCO 3 − + H 2 O ⇌ H 3 O + + CO 3 2 − c. HCO 3 − + H 2 O ⇌ H 2 CO 3 + OH − Dapat dikatakan bahwa ... Asam H 2 CO 3 mempunyai keasaman lebih besar daripada asam HCO 3 − HCO 3 − bersifat amfoter Ion CO 3 2 − merupakan basa konjugasi dari HCO 3 − Pada reaksi c di atas H 2 O bersifat sebagai asam konjugasi dari OH − (UMPTN '00 Rayon A)
Berdasarkan reaksi-reaksi dibawah ini.
a.
b.
c.
Dapat dikatakan bahwa ...
- Asam mempunyai keasaman lebih besar daripada asam
- bersifat amfoter
- Ion merupakan basa konjugasi dari
- Pada reaksi c di atas bersifat sebagai asam konjugasi dari
(UMPTN '00 Rayon A)
1, 2, dan 3 SAJA yang benar.
1 dan 3 SAJA yang benar.
2 dan 4 SAJA yang benar.
HANYA 4 yang benar.
SEMUA pilihan benar.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
6
4.8 (5 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia