Iklan
Pertanyaan
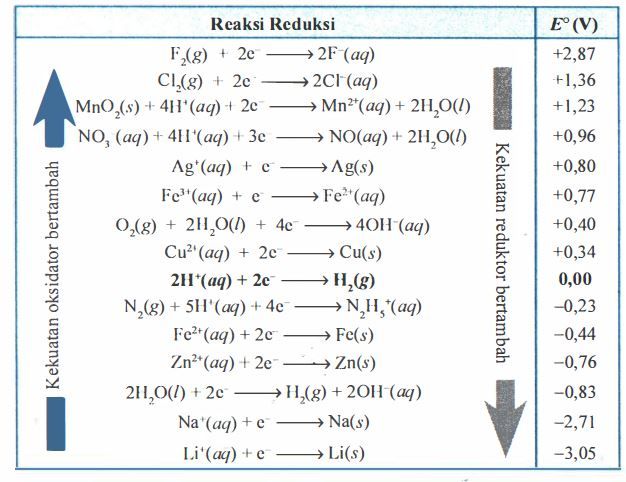
Berdasarkan data yang Anda dapatkan dari literatur, apakah reaksi berikut berlangsung secara spontan? 3 Fe 2 + ( a q ) → Fe ( s ) + 2 Fe 3 + ( a q ) Jika tidak, tuliskan persamaan kimia spontan yang terjadi, hitunglah dan susunlah urutan tiga jenis besi dalam urutan kekuatan reduktor yang makin menurun.
Berdasarkan data yang Anda dapatkan dari literatur, apakah reaksi berikut berlangsung secara spontan?
Jika tidak, tuliskan persamaan kimia spontan yang terjadi, hitunglah dan susunlah urutan tiga jenis besi dalam urutan kekuatan reduktor yang makin menurun.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
2
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia