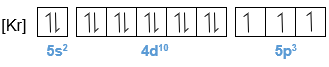Iklan
Pertanyaan
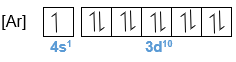
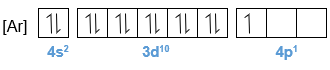
Bagan berikut ini merupakan potongan sistem periodik unsur yang tidak lengkap. Tentukanlah letak golongan dan periode dari unsur-unsur A, B, dan F. Berapa elektron tidak berpasangan yang terdapat pada atom-atom B, D, dan G? Atom manakah yang memiliki energi ionisasi terbesar? Atom manakah yang paling mudah menangkap elektron untuk membentuk ion negatif?
Bagan berikut ini merupakan potongan sistem periodik unsur yang tidak lengkap.
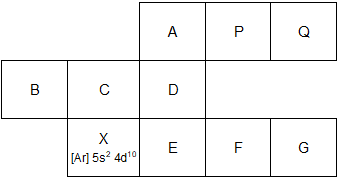
- Tentukanlah letak golongan dan periode dari unsur-unsur A, B, dan F.
- Berapa elektron tidak berpasangan yang terdapat pada atom-atom B, D, dan G?
- Atom manakah yang memiliki energi ionisasi terbesar?
- Atom manakah yang paling mudah menangkap elektron untuk membentuk ion negatif?
Iklan
SL
S. Lubis
Master Teacher
Mahasiswa/Alumni Universitas Sumatera Utara
Jawaban terverifikasi
1
5.0 (3 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia