Bentuk molekul menentukan sifat kepolaran senyawa kovalen. Jika di dalam molekul terdapat pemisahan muatan maka kerapatan elektron dalam molekul tidak merata sehingga molekul bersifat polar. Sebaliknya, jika kerapatan elektron tersebar merata maka molekul bersifat nonpolar. Senyawa kovalen ada yang bersifat polar dan ada yang nonpolar. Senyawa kovalen akan bersifat nonpolar jika molekulnya berbentuk simetris, sedangkan senyawa kovalen akan bersifat polar jika pada atom pusat dari molekul senyawa tersebut terdapat pasangan elektron bebas (PEB) sehingga bentuk molekulnya menjadi tidak simetris.
Pada soal di atas, spesi yang dapat dibentuk dari atom 53I dengan atom 17Cl adalah senyawa ICl3, kation ICl4+, dan anion ICl4−. Untuk dapat menentukan sifat kepolaran ketiga spesi tersebut, maka perlu dibuat terlebih dahulu struktur Lewisnya agar dapat terlihat molekul yang memiliki PEB dan tidak memiliki PEB. Struktur Lewis senyawa ICl3, kation ICl4+, dan anion ICl4− adalah sebagai berikut.
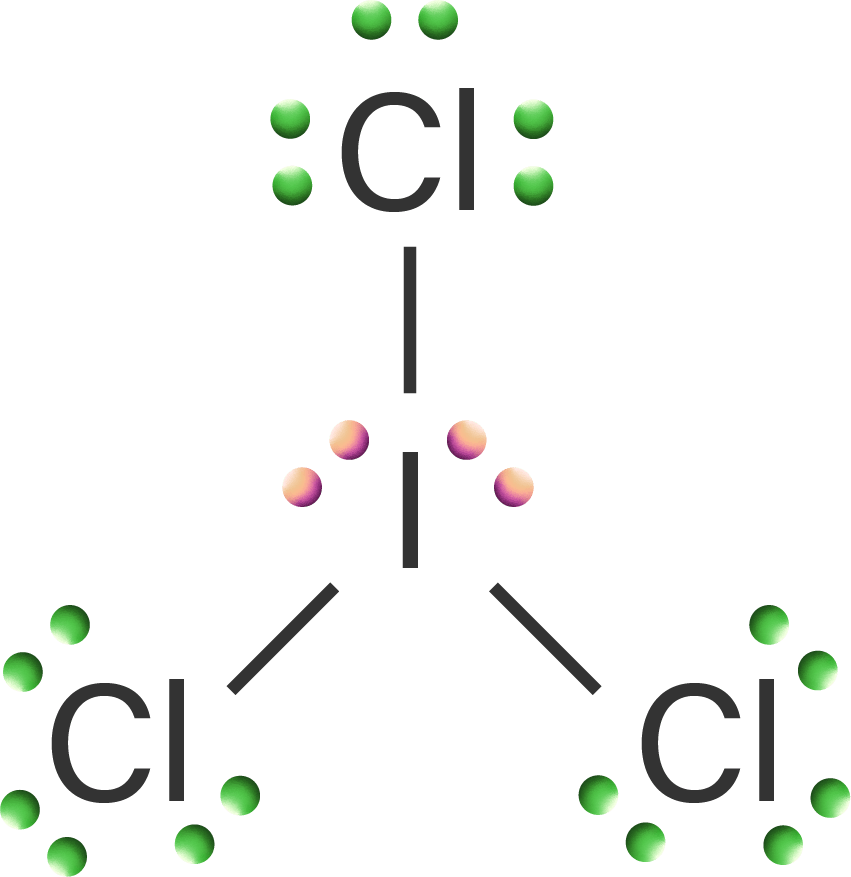
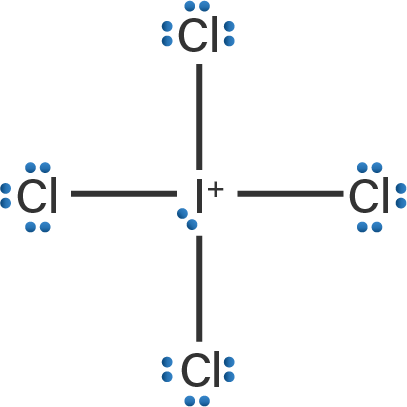

Berdasarkan struktur Lewis di atas, terlihat bahwa pada senyawa ICl3, terdapat 2 buah pasangan elektron bebas (PEB) dan 3 buah pasangan elektron berikatan (PEI). Pada kation ICl4+, atom I melepaskan 1 buah elektronnya, sehingga hanya terdapat 6 buah elektron pada atom I kemudian 4 buah elektronnya digunakan untuk berikatan dengan 4 buah atom Cl sebagai PEI dan 2 buah elektron sisanya menjadi 1 buah PEB. Pada anion ICl4−, atom I mengikat 1 buah elektron, sehingga terdapat 8 buah elektron dimiliki atom I kemudian 4 buah elektronnya digunakan untuk berikatan dengan 4 buah atom Cl sebagai PEI dan 4 buah elektron sisanya menjadi 2 buah PEB.
Sebelum menentukan bentuk molekul dan sifat kepolarannya, perlu ditentukan terlebih dahulu tipe molekulnya dengan notasi A,X, dan E, dimana A sebagai atom pusat, X sebagai pasangan elektron berikatan (PEI), dan E merupakan pasangan elektron bebas (PEB). Tipe molekul dari dan bentuk molekul dari senyawa ICl3, kation ICl4+, dan anion ICl4− adalah sebagai berikut.
- Pada senyawa ICl3, terdapat 2 buah PEB dan 3 buah PEI, maka tipe molekulnya adalah AX3E2 dan bentuk molekulnya yaitu bentuk T.

- Pada kation ICl4+, terdapat 1 buah PEB dan 4 buah PEI, maka tipe molekulnya adalah AX4E dan bentuk molekulnya yaitu tetrahedral terdistorsi atau bentuk jungkat jungkit.

- Pada anion ICl4−, terdapat 2 buah PEB dan 4 buah PEI, maka tipe molekulnya adalah AX4E2 dan bentuk molekulnya yaitu segi empat planar.

Berdasarkan bentuk molekul dari senyawa ICl3, kation ICl4+, dan anion ICl4− di atas, bentuk molekul yang menunjukkan senyawa nonpolar adalah bentuk segi empat planar yang dimiliki oleh anion ICl4−. Hal ini disebabkan karena kerapatan elektron yang tersebar merata sehingga bentuk molekulnya menjadi simetris.
Dengan demikian, maka spesi yang bersifat nonpolar adalah anion ICl4−.
Jadi, jawaban yang tepat adalah B.


















