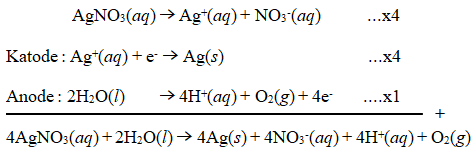Iklan
Pertanyaan
Arus sebesar 965 coulomb dialirkan ke dalam 500 mL larutan AgNO 3 . Tentukan: a. persamaan reaksi elektrolisisnya, b. massa perak yang dihasilkan di katode, c. volume gas yang terjadi di anode, dan d. pH larutan setelah reaksi berakhir.
Arus sebesar 965 coulomb dialirkan ke dalam 500 mL larutan . Tentukan:
a. persamaan reaksi elektrolisisnya,
b. massa perak yang dihasilkan di katode,
c. volume gas yang terjadi di anode, dan
d. pH larutan setelah reaksi berakhir.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
4.0 (6 rating)
AA
Amalia Ana Alhayir
Pembahasan lengkap banget
EV
Elvina Vitriana
Pembahasan tidak menjawab soal
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia