Titrasi adalah penambahan larutan baku (larutan yang telah diketahui dengan tepat konsentrasinya) ke dalam larutan lain dengan bantuan indikator sampai tercapai titik ekuivalen. Titrasi dihentikan tepat pada saat indikator menunjukkan perubahan warna. Saat perubahan warna indikator disebut titik akhir titrasi.
Suatu asam yang mempunyai pH kurang dari 7 jika ditambah basa yang pH–nya lebih dari 7, maka pH asam akan naik, sebaliknya suatu basa jika ditambah asam, maka pH basa akan turun. Apabila penambahan zat dilakukan tetes demi tetes kemudian dihitung pH–nya akan diperoleh kurva titrasi, yaitu grafik yang menyatakan pH dan jumlah larutan standar yang ditambah.
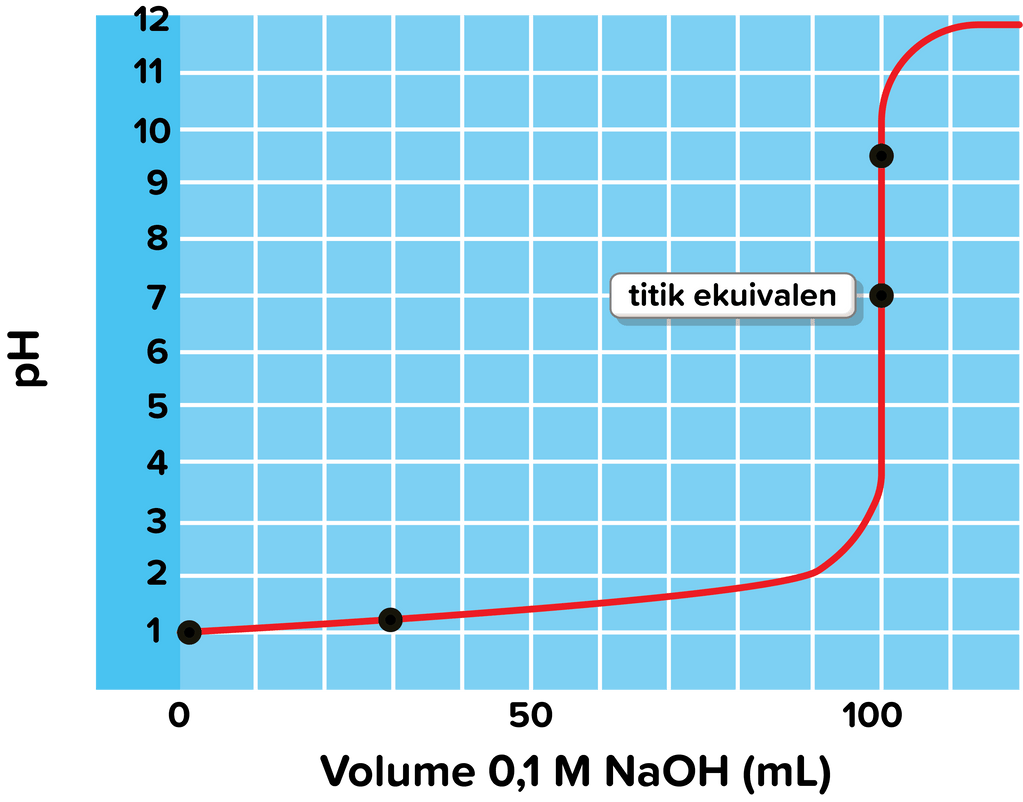
a. Berdasarkan kurva titrasi pada soal, diketahui bahwa pH larutan awal adalah 1, dan perlahan-lahan pH mulai naik hingga mencapai titik ekivalennya. Dengan demikian, maka larutan yang dititrasi adalah larutan asam kuat dengan pH = 1. Asam kuat ini dapat berupa larutan  ,
,  ,
,  maupun
maupun  .
.
b. Larutan yang dititrasi merupakan larutan asam kuat, karena pH larutan awal adalah 1, sedangkan larutan yang digunakan untuk menitrasi adalah larutan basa kuat  0,1 M. Hal ini dapat diketahui dari sumbu X (mendatar) pada kurva, yang menunjukkan bahwa larutan basa kuat
0,1 M. Hal ini dapat diketahui dari sumbu X (mendatar) pada kurva, yang menunjukkan bahwa larutan basa kuat  0,1 M yang menitrasi larutan asam.
0,1 M yang menitrasi larutan asam.
c. Kurva titrasi di atas merupakan kurva titrasi dari basa kuat  0,1 M dan asam kuat dengan pH = 1. Untuk titrasi asam kuat oleh basa kuat, besarnya pH saat titik ekuivalen adalah 7. Pada pH ini asam kuat tepat habis bereaksi dengan basa kuat, sehingga larutan yang terbentuk adalah air dan garam yang bersifat netral.
0,1 M dan asam kuat dengan pH = 1. Untuk titrasi asam kuat oleh basa kuat, besarnya pH saat titik ekuivalen adalah 7. Pada pH ini asam kuat tepat habis bereaksi dengan basa kuat, sehingga larutan yang terbentuk adalah air dan garam yang bersifat netral.
d. Pada grafik, diperlihatkan ciri penting dari kurva titrasi asam kuat-basa kuat bahwa pH berubah secara lambat sampai dekat titik ekuivalen. Penambahan  menyebabkan harga pH naik sedikit demi sedikit. Namun, pada titik ekuivalen, pH meningkat sangat tajam kirakira 6 unit (dari pH 4 sampai pH 10) hanya dengan penambahan 0,1 mL (± 2 tetes). Setelah titik ekuivalen, pH berubah amat lambat jika ditambah
menyebabkan harga pH naik sedikit demi sedikit. Namun, pada titik ekuivalen, pH meningkat sangat tajam kirakira 6 unit (dari pH 4 sampai pH 10) hanya dengan penambahan 0,1 mL (± 2 tetes). Setelah titik ekuivalen, pH berubah amat lambat jika ditambah  . Dengan demikian, maka jika jumlah penetrasi berlebih, maka pH larutan akan >7.
. Dengan demikian, maka jika jumlah penetrasi berlebih, maka pH larutan akan >7.
e. Indikator-indikator yang perubahan warnanya berada dalam bagian terjal kurva titrasi ini, yaitu indikator yang mempunyai trayek pH antara 4 sampai 10 cocok digunakan untuk titrasi tersebut. Indikator yang dapat digunakan pada titrasi ini adalah metil merah, bromtimol biru, dan fenolftalein. Tetapi, larutan indikator yang paling cocok adalah fenolftalein. Hal ini karena fenolftalein memiliki trayek pH 8,3–10,0 dan perubahan warna yang mencolok, yaitu dari tidak berwarna menjadi merah. Penggunaan fenolftalein pada titrasi asam kuat-basa kuat akan memperlihatkan perubahan warna merah seulas saat tercapai titik akhir titrasi.
Jadi, larutan yang dititrasi adalah larutan asam kuat, larutan yang digunakan untuk menitrasi adalah larutan  0,1 M, pH saat titik ekuivalen adalah 7, jika jumlah penetrasi berlebih, maka pH larutan akan >7 dan larutan indikator yang paling cocok adalah fenolftalein.
0,1 M, pH saat titik ekuivalen adalah 7, jika jumlah penetrasi berlebih, maka pH larutan akan >7 dan larutan indikator yang paling cocok adalah fenolftalein.